Nat Chem:陈加余团队系统揭示三链体DNA互作蛋白调控机制与功能多样性
来源:生物探索 2024-09-08 11:11
该研究首次系统地揭示了内源性三链体DNA调控蛋白的全景图,不仅为深入理解三链体DNA的动态调控奠定了基础,也为诸多蛋白的分子功能研究提供了全新视角。
DNA右手双螺旋结构的提出开启了分子生物学新篇章【1】。事实上,除右手双螺旋结构外,还存在其他非经典DNA构象,如三链体DNA(triplex DNA)。三链体DNA是由单链DNA通过胡斯坦氢键(Hoogsteen hydrogen bonds)与双链DNA的大沟特异性结合形成的一种三链结构【2】。该结构在基因组中广泛分布,发挥重要的基因调控作用,并可导致基因组不稳定性。基于以上功能,三链体形成寡核苷酸(triplex forming oligonucleotides)既是调节基因表达,诱导突变、重组和凋亡的分子工具,又在定点交联顺铂药物【3】和特异性杀伤原癌基因扩增的癌细胞【4】等方面展示出巨大应用价值,具备成为新型核酸药物的潜力。然而,关于细胞内三链体DNA动态的调控网络与分子机制尚未得到充分解析,极大阻碍了三链体DNA的基础研究与转化应用。
2024年9月2日,南京大学陈加余课题组在Nature Chemistry杂志发表了题为“Chemoproteomic profiling unveils binding and functional diversity of endogenous proteins that interact with endogenous triplex DNA”的研究论文,首次系统性揭示了内源性三链体DNA互作蛋白及其多样化的调控模式与分子功能【5】。

当前,三链体DNA调控蛋白的发现及其分子机制解析主要依赖体外实验,其准确性和可推广性有待商榷。为实现在活细胞中系统捕获内源三链体DNA互作蛋白,作者开发了特异性识别三链体DNA的光交联化学探针photoBQQ。该探针在Benzoquinoquinoxaline(BQQ)分子的基础上增加了双吖丙啶(diazirine)和炔基(alkyne)基团。双吖丙啶具有紫外光交联活性,而炔基基团可通过点击化学反应连接生物素,以便后续富集。作者通过一系列体外和体内实验证实了photoBQQ探针对三链体DNA的特异性识别能力及其对三链体DNA调控蛋白的临近标记活性。利用该探针,作者在HeLa和A549细胞系中开展了化学蛋白质组学研究,特异性捕获并通过定量质谱成功鉴定了78个高置信度的三链体DNA互作蛋白,为理解三链体DNA的动态调控机制奠定了坚实基础。
随后,作者通过多组学数据(ChIP-seq,CUT&Tag,S1-END-seq等)的联合分析揭示了这些调控蛋白的分子调控机制及潜在生物学功能。作者对这些蛋白的DNA结合位点与三链体DNA形成区域进行了系统比对,识别出三种截然不同的结合模式(图1)。不同结合模式对应不同的调控机制和生物学过程。值得注意的是,先前研究难以区分内源性三链体DNA的构型,而该研究通过分析单链多聚胞苷酸结合蛋白HNRNPK、PCBP1和PCBP2的结合模式,推断出内源性三链体DNA主要采用H-r3构型。
该重要发现也解决了HNRNPK、PCBP1和PCBP2蛋白的DNA结合位点相较于其RNA结合位点存在偏移的这一领域内悬而未决的难题【6】。此外,HNRNPK、PCBP1和PCBP2蛋白的转录调控功能或许也与其结合内源性三链体DNA的活性密切相关【7】。
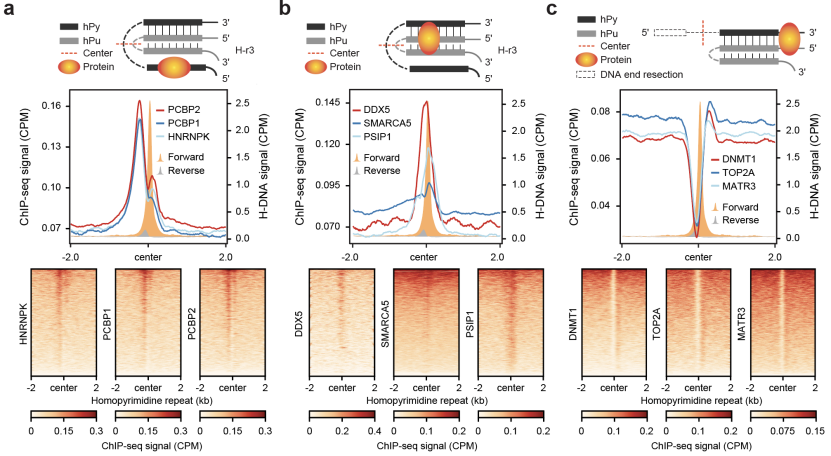
图1 – 三链体DNA调控蛋白的不同结合模式(Credit: Nature Chemistry)
最后,作者以新发现的三链体DNA调控蛋白DDX3X为例,进行了深入的分子机制研究。通过体外解旋酶实验,作者发现DDX3X能够以不依赖ATP的方式解旋三链体DNA,并且尤其偏好第三链5′端存在额外单链DNA(5′ overhang)的三链体DNA。据作者了解,DDX3X是迄今为止发现的唯一一个ATP非依赖的三链体DNA解旋酶。进一步的免疫荧光实验显示,DDX3X缺失会导致三链体DNA的累积并诱发DNA损伤。通过CUT&Tag实验,作者发现DDX3X调控的三链体DNA与DNA损伤位点高度共定位。最后,通过连接介导的PCR实验(LM-PCR)证实,DDX3X缺失导致DNA损伤的分子机制是三链体DNA区域发生双链断裂(图2)。这些发现为理解 DDX3X 在各种生理过程和疾病中的分子机制提供了新思路。
总之,该研究首次系统地揭示了内源性三链体DNA调控蛋白的全景图,不仅为深入理解三链体DNA的动态调控奠定了基础,也为诸多蛋白的分子功能研究提供了全新视角。这一研究还为探索三链体DNA的生物学功能及其在转化医学中的应用提供了宝贵资源。
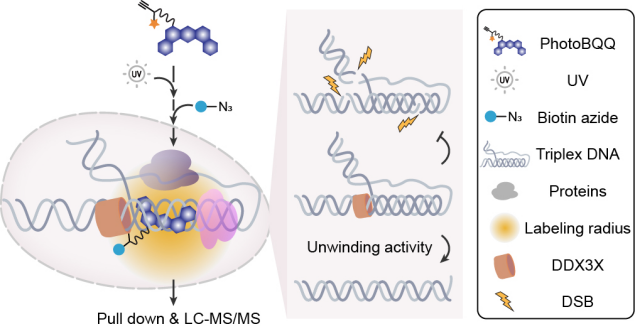
图2 – 化学蛋白质组学鉴定到的DDX3X通过解旋三链体DNA防止DNA损伤(Credit: Nature Chemistry)
参考文献:
1 Watson, J. D. & Crick, F. H. Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid. Nature 171, 737-738 (1953). https://doi.org:10.1038/171737a0
2 Frank-Kamenetskii, M. D. & Mirkin, S. M. Triplex DNA structures. Annu Rev Biochem 64, 65-95 (1995). https://doi.org:10.1146/annurev.bi.64.070195.000433
3 Hennessy, J. et al. A Click Chemistry Approach to Targeted DNA Crosslinking with cis-Platinum(II)-Modified Triplex-Forming Oligonucleotides. Angew Chem Int Ed Engl 61, e202110455 (2022). https://doi.org:10.1002/anie.202110455
4 Kaushik Tiwari, M. et al. Direct targeting of amplified gene loci for proapoptotic anticancer therapy. Nat Biotechnol 40, 325-334 (2022). https://doi.org:10.1038/s41587-021-01057-5
5 Xu, H. et al. Chemoproteomic profiling unveils binding and functional diversity of endogenous proteins that interact with endogenous triplex DNA. Nat Chem (2024). https://doi.org:10.1038/s41557-024-01609-7
6 Van Nostrand, E. L. et al. A large-scale binding and functional map of human RNA-binding proteins. Nature 583, 711-719 (2020). https://doi.org:10.1038/s41586-020-2077-3
7 Xiao, R. et al. Pervasive Chromatin-RNA Binding Protein Interactions Enable RNA-Based Regulation of Transcription. Cell 178, 107-121 e118 (2019). https://doi.org:10.1016/j.cell.2019.06.001
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


