《科学》重磅:直接“冰镇”神经,这种镇痛手段你想过吗?
来源:奇点糕 2022-07-26 10:15
当将SNI小鼠的患侧坐骨神经从36℃冷却到10℃时,让小鼠产生痛觉的机械荷载阈值提高了6倍,而未植入冷却装置的一侧对机械荷载的敏感性则没有改变(图7)。上述数据展示了该装置良好的镇痛效果。
据统计,世界上每五个成年人中,就有一人正在遭受疼痛折磨[1]。
阿片类药物可有效镇痛,但会引起呕吐、头晕及意识障碍,而且还有一定的成瘾性。
近年来,人们发现冷却神经可以抑制疼痛信号的传递,以物理方式实现镇痛,从而避免阿片类药品的不良影响。因此,这类技术具有极大的应用前景。
然而,受预冷液体和复杂设备等限制,如何在生物体中精准地实现神经局部冷却仍然是一大挑战。
近日,由美国西北大学John A. Roger教授和俄勒冈大学Jonathan T. Reeder助理教授领衔的研究团队,在著名期刊《科学》发表了重要研究成果[2]。
这个团队集成微流体和柔性电子技术,开发了一种微型可植入的冷却系统,为精准低温镇痛提供一种有效替代方案。值得一提的是,我国大连理工大学解兆谦教授是该文章的共同第一作者。

论文首页截图
人体组织在受到伤害时,会产生特定的电信号。疼痛信号经神经传入大脑,使人感知疼痛。
冷却神经可以有效降低神经组织中的代谢、电生成和离子活性,从而阻断信号传递,以抑制疼痛。当神经温度降至15℃时可阻断复合神经动作电位传递,而在5℃时可实现完全的神经阻滞[3]。
受上述理论启发,Roger团队提出了实现无药镇痛的新途径:在生物体内植入柔性电子装置对神经进行冷却(图1)。
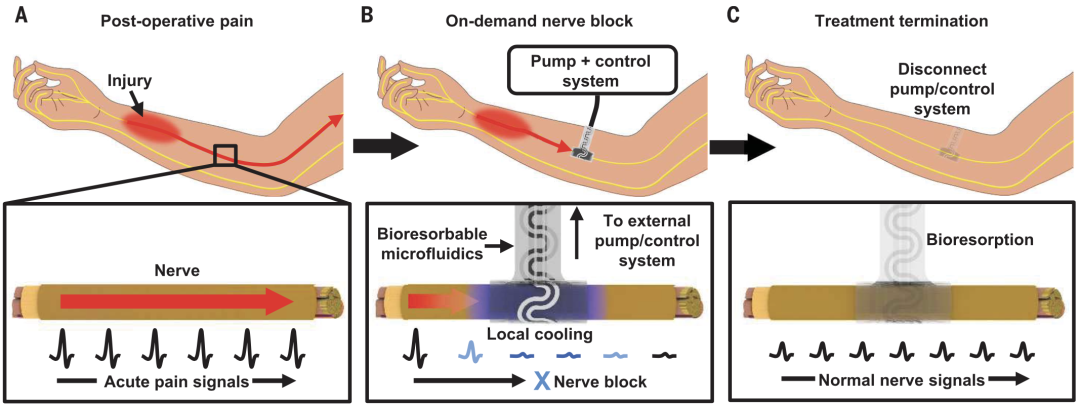
图1. 冷却神经可消除神经电活动和疼痛信号。
该柔性电子装置由微流体系统和温度传感器组成,可在冷却神经同时测量神经周围的温度。值得一提的是,这个装置由完全可被生物吸收的材料组成,植入体内后可被吸收、降解,从而避免二次手术拆除。
研究人员利用这种材料良好的弹性并通过结构设计,使冷却装置的弹性模量与神经的弹性模量接近,并使这一装置的末端卷曲成筒状,无需缝合即可紧密贴合在神经表面,为神经提供高效的热交换面(图2)。
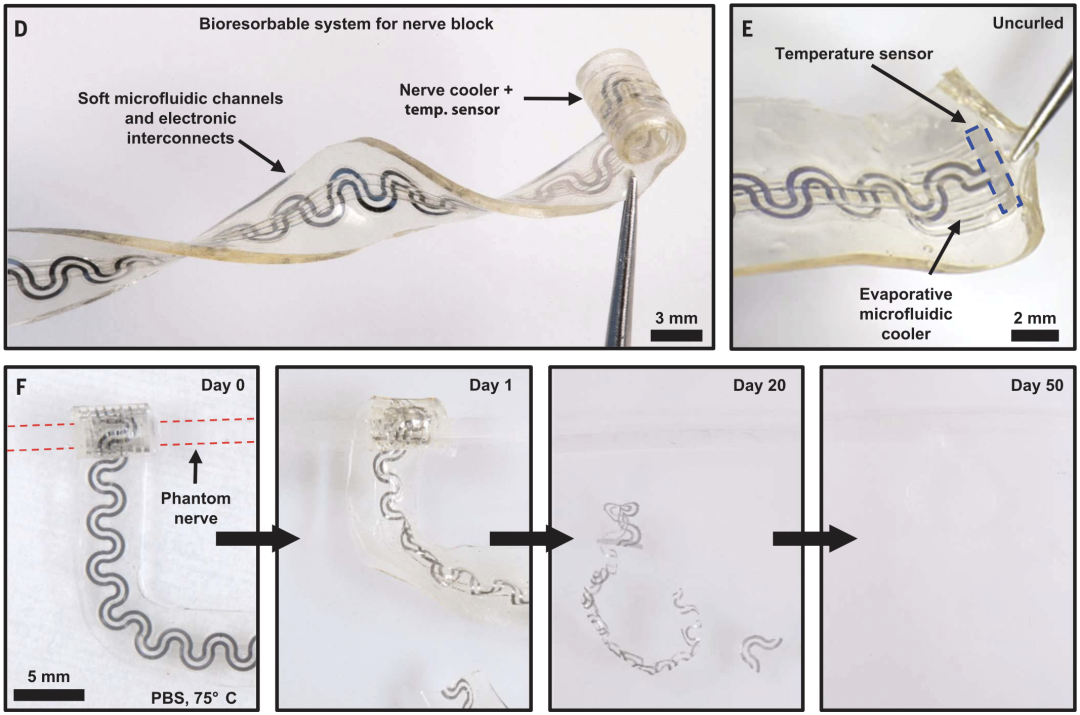
图2. 基于微流系统和温度传感器的柔性冷却器件。
从上图中可以看出,这个器件的宽度仅有数毫米。如此微小的装置是如何降温的呢?
Roger团队创新性地利用了蒸发吸热这一简单的物理现象,在微流体系统中注入沸点约30℃的全氟戊烷(PFP)作为冷却剂,并同时注入氮气控制其蒸发速度,从而实现温度可控的冷却。
在这一器件的末端还设有蒸发腔,当PFP和氮气同时流入这一密闭腔室时,液态PFP迅速蒸发,从而实现降温(图3 A和B)。PFP的蒸发速度决定了冷却的效果,而氮气和PFP间的流量比又决定了PFP的蒸发速度。液体PFP蒸发量越大,冷却温度越低。
Roger团队通过实验发现,当PFP流量较小时(摩尔流量比为0.1),液态PFP通过蛇形管后几乎完全蒸发,腔室回路中仅有少量液态PFP存留(图3 C);而当PFP流量较大时(摩尔流量比为0.5),其主要以液态的形式通过环状流再次流出蒸发室(图3 D)。实验结果表明,通过调节PFP蒸发,可以在2分钟内将器件周围温度降至-20℃,同时器件自带的温度传导器也可对降温效果进行反馈。
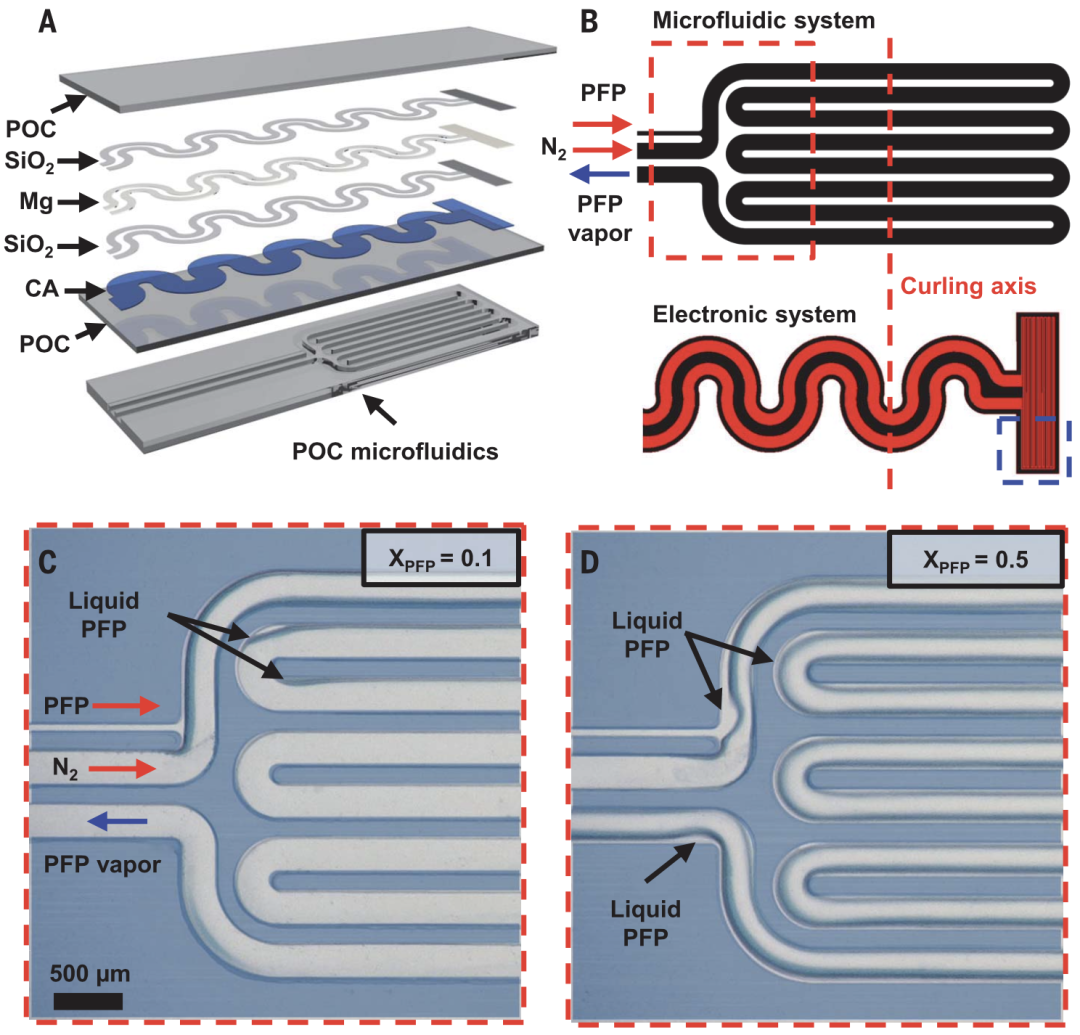
图3. 微流体系统的冷却原理
由以上结果可知,该装置具有良好的降温效果。然而,过度冷却会损伤神经,因此,冷却的温度和时间必须被精准控制。那么,该装置是如何现实精准控温的?
Reeder等发现,通过调节流入蒸发腔的PFP与氮气的比例,可以精确地控制冷却效果。例如,在流入氮气的气压为90KPa的条件下,PFP与氮气的流量比为0.13时冷却效果最好,可将神经温度降至-1.4℃。
通过大量实验数据,Reeder等不仅掌握了PFP和氮气的摩尔流速与温度之间的关系,而且还通过不断调节PFP的流量实现了时间可控的复温。在此基础上,他们还展示了该装置的控温能力:被包裹的神经束温度被精准地维持在3℃长达15分钟(图4)。
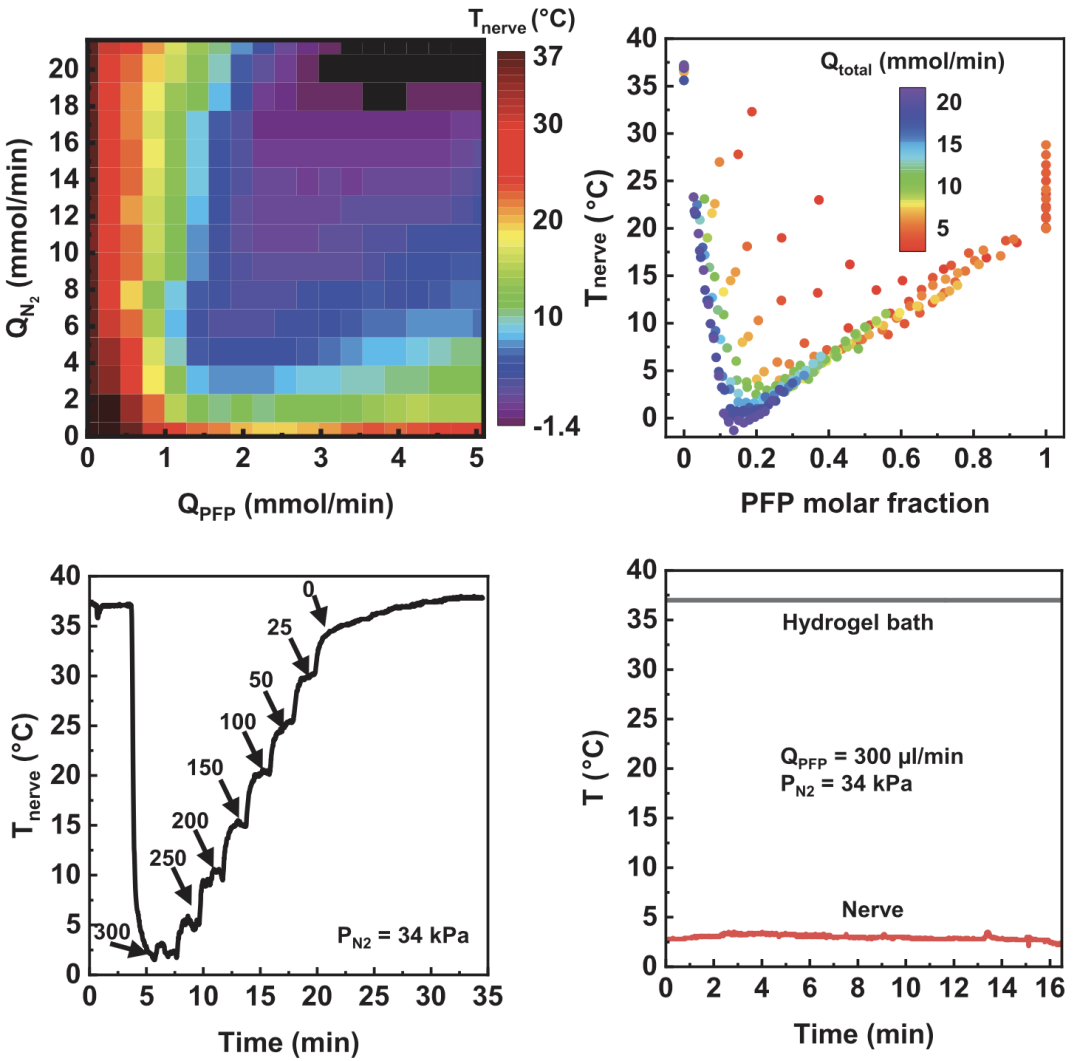
图4. 精准控制温度的效能
除了精准的温度控制外,理想的装置还应将降温限制在神经局部,从而避免损伤神经旁的组织器官。不过,Roger团队开发的这个装置可以在无需额外保温层的情况下,将降温限制在很小的范围内。
为了展示该装置的局部控温能力,Reeder等在实验中考虑了3种可能的放置方式:卷曲后垂直放置(图5A)、卷曲后水平放置(图5B),以及平铺(图5C)。
实验结果显示,在前两种情况中,降温均被局限在器件末端的筒状内部,而第三种情况下,降温范围与蒸发腔的位置重合(图5D-F)。此外,他们还进一步采用三维有限元分析,验证了实验中所测得的局部降温效果(图5G-I)。
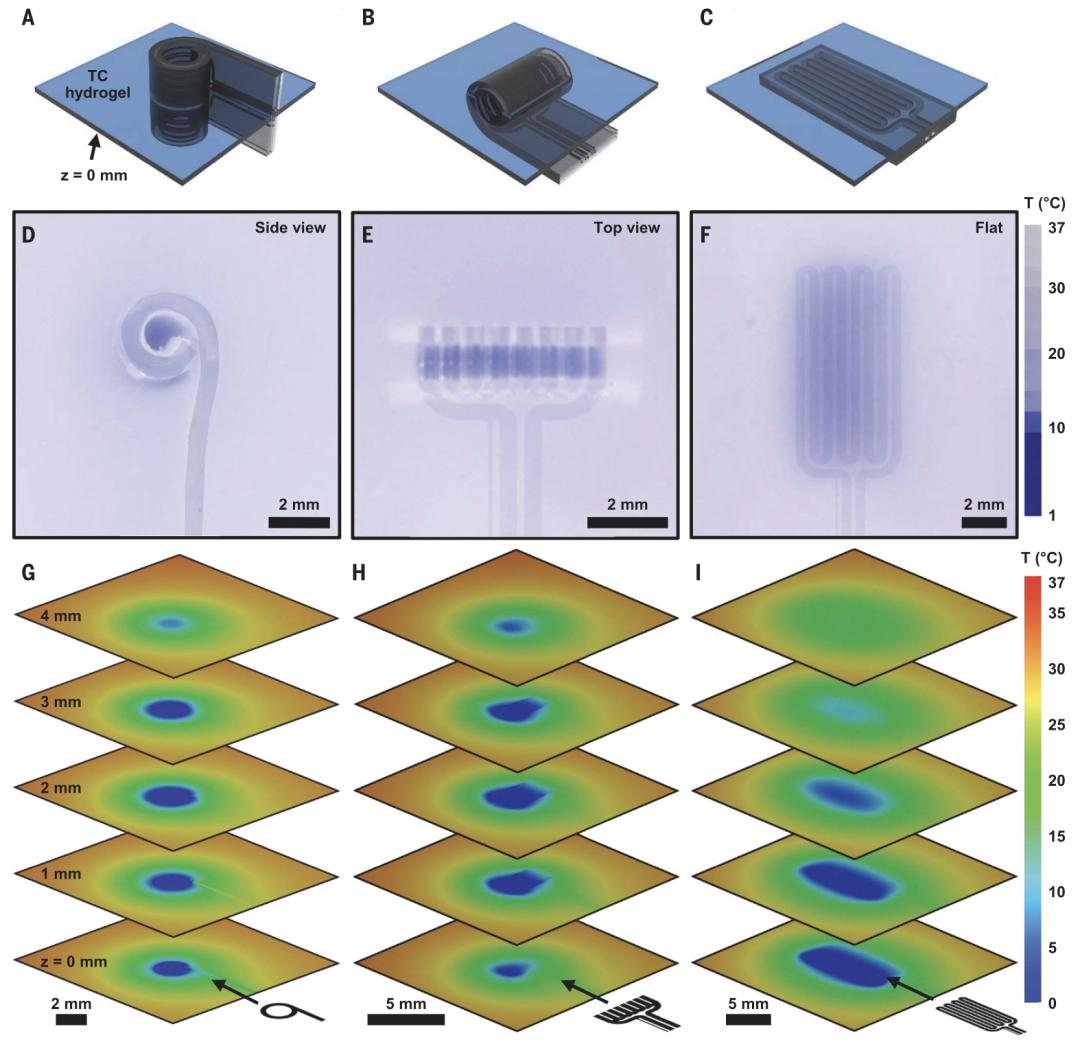
图5. 该柔性器件可实现精准的局部冷却
作为本研究的亮点之一,Roger团队也通过动物实验验证了该装置的镇痛效果。为此,他们建立了选择性神经损伤模型(SNI)。
SNI是一种神经损伤致痛敏的动物模型,其特点是机械性痛觉敏感出现早、持续时间长,是常用的疼痛模型之一。Reeder等在SNI小鼠的一侧坐骨神经上包裹该装置,对其进行降温并测量神经肌肉的信号传导。
胫骨前肌的肌电图(EMG)显示:当神经温度从31℃降至5℃时,EMG信号振幅降低且延迟增加;而伴随着复温,神经电活动的振幅及传导频率也随之恢复(图6)。
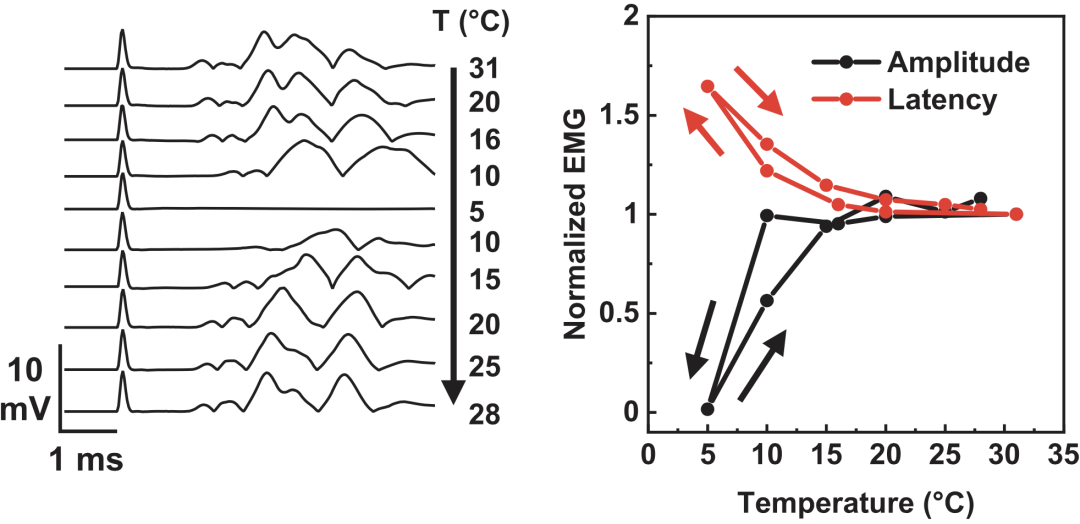
图6. 冷却神经可降低神经信号振幅并延迟传导
Reeder等进一步采用该模型进行长期实验来评估该器件的镇痛效果。为了在自由活动的小鼠上植入该装置,他们设计了一种头帽,以集成温度信号的采集和流体的输入与输出功能。
在使用柔性冷却装置包裹SNI小鼠的患侧坐骨神经后,Reeder等将线管经脊柱皮下连接到头帽以对外界进行交互。利用这一模型,他们开展了机械痛觉敏感实验。
实验数据显示,当将SNI小鼠的患侧坐骨神经从36℃冷却到10℃时,让小鼠产生痛觉的机械荷载阈值提高了6倍,而未植入冷却装置的一侧对机械荷载的敏感性则没有改变(图7)。上述数据展示了该装置良好的镇痛效果。
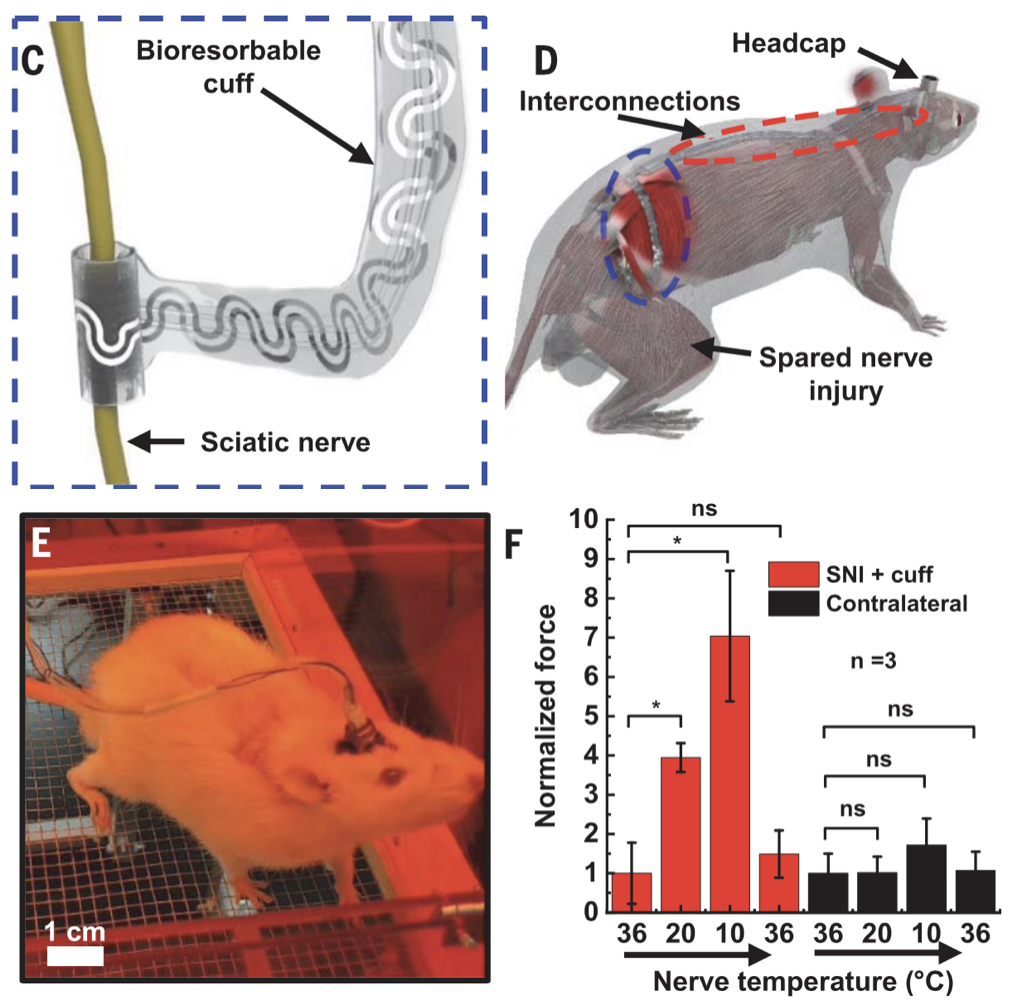
图7. 冷却坐骨神经可有效镇痛
在《科学》同期发布的评论性文章中,斯坦福大学材料系洪国松教授高度称赞了该项研究[4],他认为这种可穿戴的冷却设备有助于实现即时镇痛,为按需止痛提供了一种非阿片类药物替代方式,可以实现长期的按需疼痛管理。
实际上,除了用于镇痛之外,这一技术也为神经科学研究提供了新型的技术手段。例如,可用于大脑皮质的高精度冷却,用于控制灵长类动物的脑神经活动等。
参考文献
[1]Goldberg D S, McGee S J. Pain as a global public health priority[J]. BMC public health, 2011, 11: 770.
[2]Reeder J T, Xie Z, Yang Q, et al. Soft, bioresorbable coolers for reversible conduction block of peripheral nerves[J]. Science (New York, N.Y.), 2022, 377(6601): 109–115.
[3]Morgan T, Zhang Y, Pace N, et al. Thermal block of mammalian unmyelinated C fibers by local cooling to 15-25°C after a brief heating at 45°C[J]. Journal of Neurophysiology, 2020, 123(6): 2173–2179.
[4]Jiang S, Hong G. Cooling the pain[J]. Science (New York, N.Y.), 2022, 377(6601): 28–29.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


