《癌细胞》:让“翻译错误”要了癌细胞的命!最新研究发现,靶向TYW2可使癌细胞在翻译过程中产生“框外肽”,增强自身免疫原性
来源:奇点糕 2025-03-31 09:04
证实可通过靶向转运核糖核酸修饰蛋白TYW2,诱导癌细胞发生翻译失调,产生具有免疫原性的“框外肽段”(out-of-frame peptides),进而使CD8+T细胞更好地识别并消灭癌细胞。
以色列魏茨曼科学研究所团队在Cancer Cell期刊发表了最新研究成果[1],证实可通过靶向转运核糖核酸(tRNA)修饰蛋白TYW2,诱导癌细胞发生翻译失调,产生具有免疫原性的“框外肽段”(out-of-frame peptides),进而使CD8+T细胞更好地识别并消灭癌细胞,TYW2表达水平也被证实与黑色素瘤患者对PD-1抑制剂治疗的应答相关。
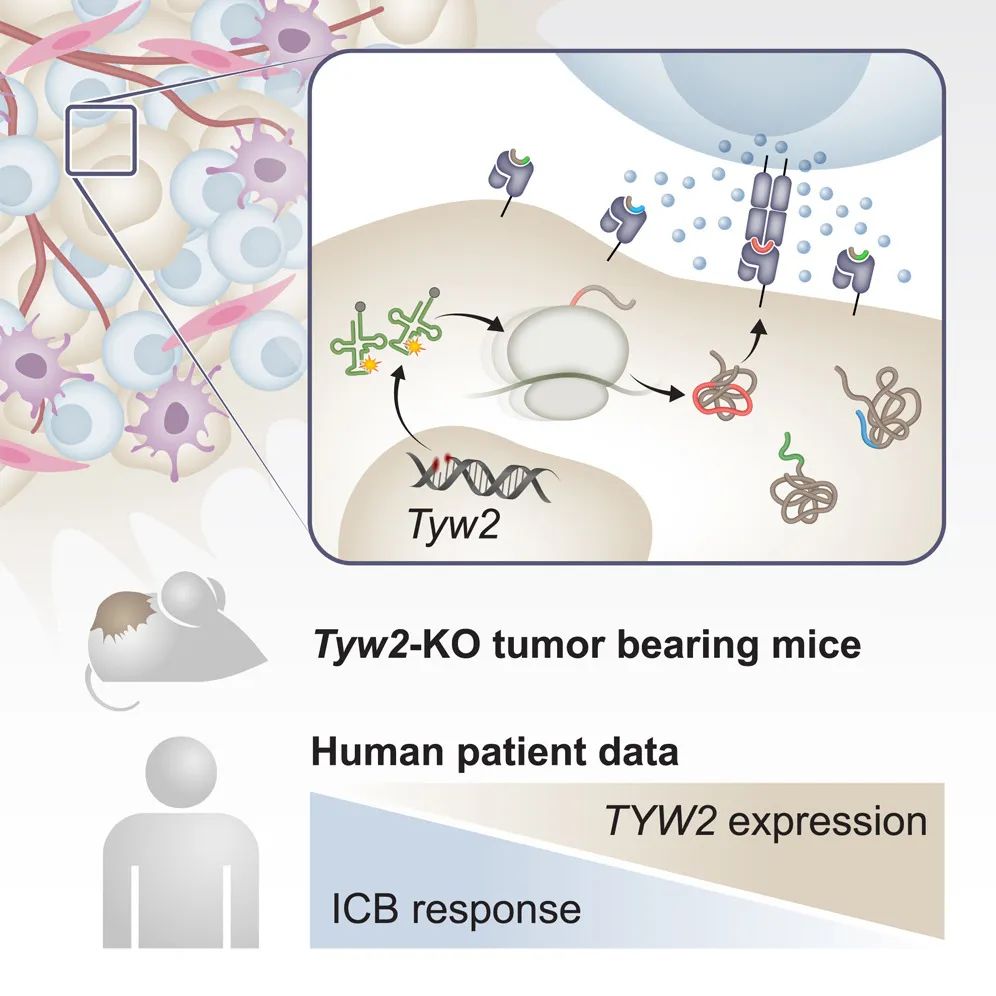
一图总结论文核心内容
其实翻译过程出现错误,也算是癌细胞的普遍特征,只不过从癌细胞的角度来看,这些错误可能是为了自身疯狂增殖、适应肿瘤微环境等目的,但从抗癌治疗角度来看,就要让这些翻译错误“为我所用”,而tRNA已经被认为是双方争夺的重要阵地之一[2],所以以色列研究者们就尝试以TYW2这个tRNA修饰蛋白为研究目标,看看敲除它会对癌细胞有何影响。
用CRISPR敲除黑色素瘤细胞的TYW2后,研究者们不仅观察到由TYW2调控的tRNA相应修饰(苯丙胺酸tRNA的37位鸟苷被羟基化或过氧化,简称yW37修饰)消失,且癌细胞内的程序性核糖体移码(PRFs)发生率明显上升,意味着mRNA的翻译产物将与正常时不同,出现大量可读框外的片段,而这正是因为yW37修饰消失,使核糖体在特定密码子的停留时间显著延长。
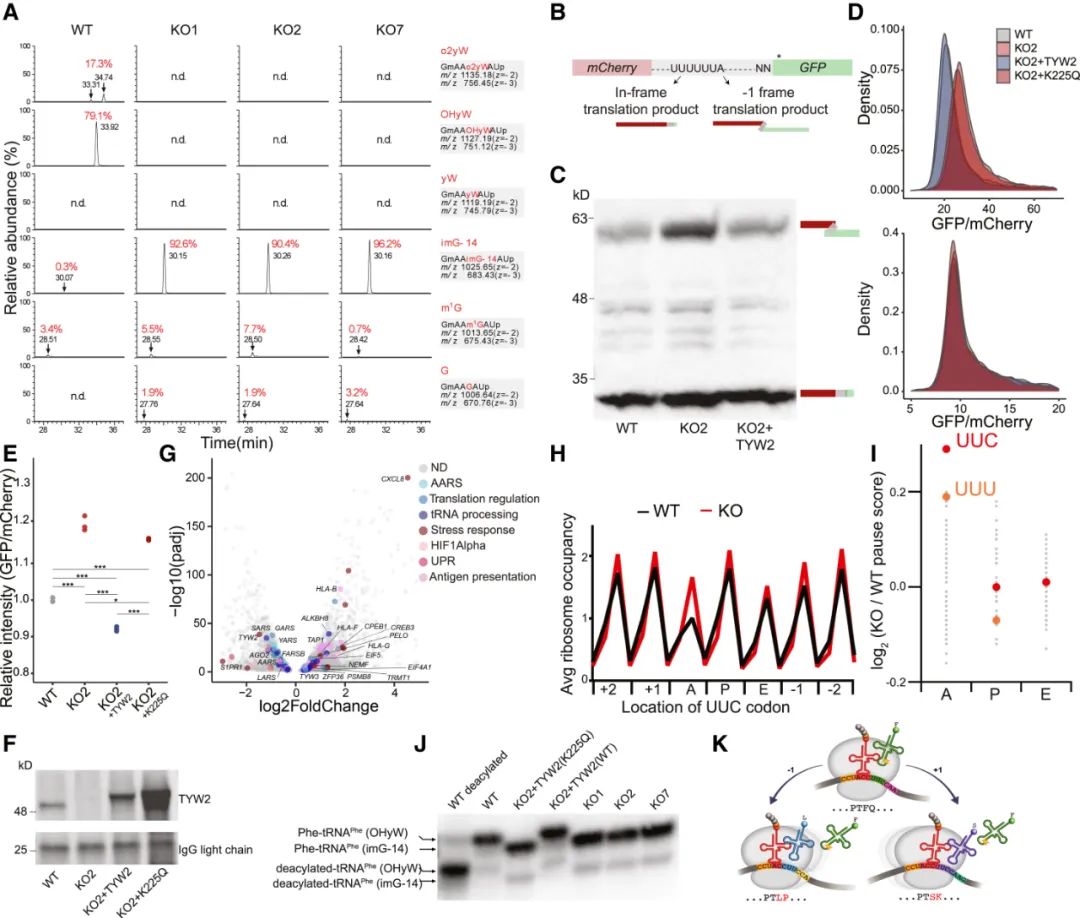
TYW2缺失会使癌细胞PRFs发生率增加
而因翻译过程出错产生的各种“缺陷产物”,如框外肽段往往就会被细胞内的HLA分子呈递而具有免疫原性。研究者们进行的免疫肽组学分析证实,敲除TYW2确实使黑色素瘤细胞内产生了大量框外肽段,它们也会被细胞内源性HLA分子呈递,连降解产物也和正常癌细胞有明显差异。那么从理论上说,这些框外肽段就可能具有免疫原性,或可激活免疫应答。
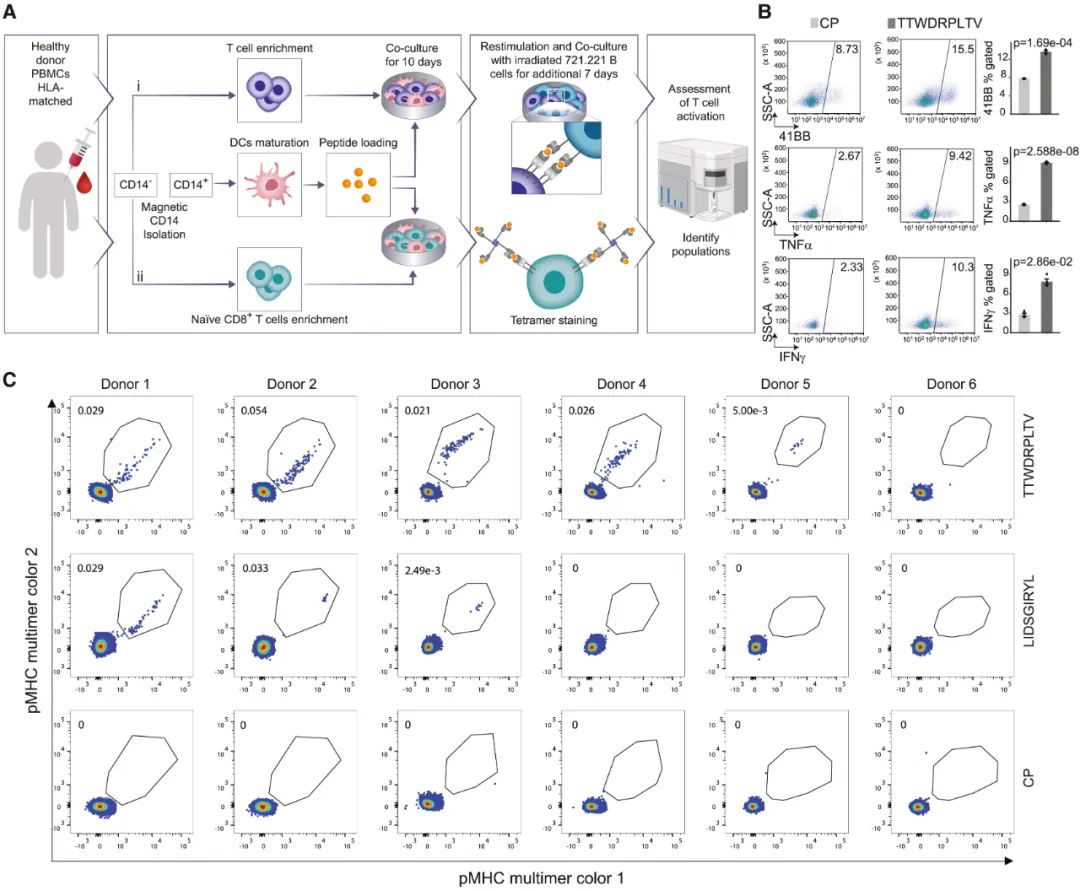
敲除TYW2后产生的框外肽段被证实具有免疫原性
接下来,研究者们将健康人的外周血单个核细胞(PBMCs)与已装载框外肽段的树突状细胞进行共培养,证实近一半被分离的框外肽段(11种中的5种)足以显著激活CD8+T细胞,且它们的免疫原性甚至高于有着相同突变的已知新表位(neoepitope)。既然如此,照理来说TYW2缺失就会使免疫系统更好地监视和杀伤癌细胞,从而抑制肿瘤生长。
后续实验也证实,被敲除TYW2的黑色素瘤细胞在模型小鼠体内增殖速度明显较野生型更慢,且该效应依赖于小鼠免疫系统健全;敲除TYW2肿瘤内的CD8+T细胞浸润显著增多,PD-1抑制剂也因此有更好的疗效。来自人类黑色素瘤患者的数据也证实,肿瘤低表达TYW2与患者生存预后更好、免疫治疗应答率更高相关,且TYW2的影响与肿瘤突变负荷(TMB)无关,而与免疫应答激活基因高表达显著相关。
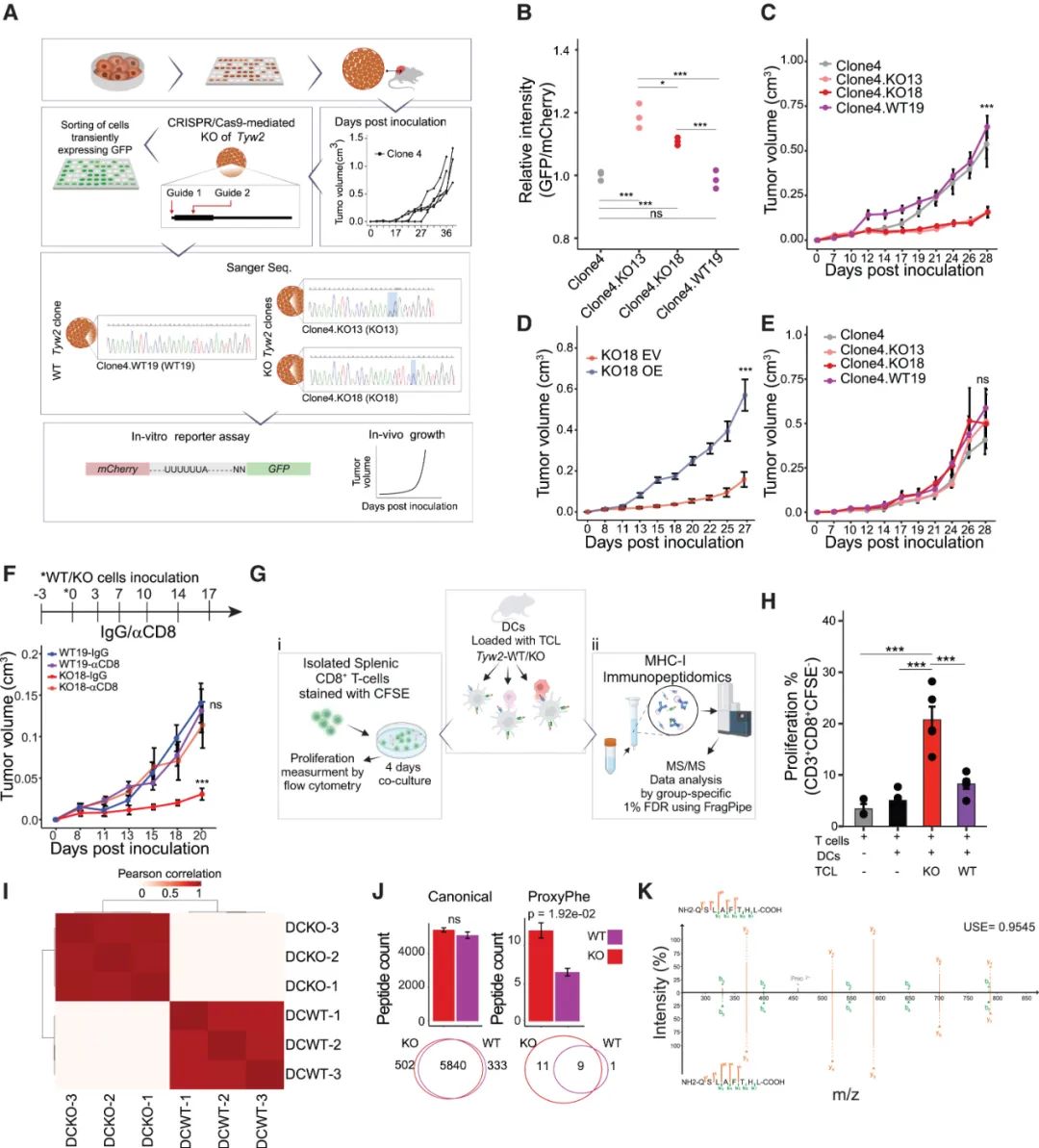
敲除TYW2可有效激活CD8+T细胞免疫应答抑癌
总而言之,本次研究至少确证了TYW2作为增效免疫治疗干预靶点的价值,至于能不能在癌细胞翻译调控因子中翻出更多类似的靶点,就要看后续研究的成果啦。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


