2025年4月Cell期刊精华
来源:生物谷原创 2025-05-03 10:32
我国科学家揭示ecDNA维持与DNA损伤应答之间的相互作用、人工智能揭示基因PHGDH才是阿尔茨海默病的病因,并确定一种潜在的药物化合物
2025年4月份已经结束,4月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.肿瘤演化的“秘密武器”!Cell:我国科学家揭示ecDNA维持与DNA损伤应答之间的相互作用
DOI: 10.1016/j.cell.2025.04.012
在肿瘤细胞的复杂世界中,染色体外 DNA(ecDNA)作为一种独特的环状 DNA,正逐渐崭露头角。它不仅在大多数人类癌症中普遍存在,还携带促癌基因,极大地增强了肿瘤的遗传异质性,助力肿瘤适应环境变化,并恶化患者预后。然而,ecDNA的复制和维持机制,以及它如何与细胞内的 DNA 损伤应答(DDR)相互作用,一直是未解之谜。近期,中国科学院深圳先进技术研究院甘海云教授课题组在《Cell》杂志上发表的研究,为我们揭开了这一神秘面纱。
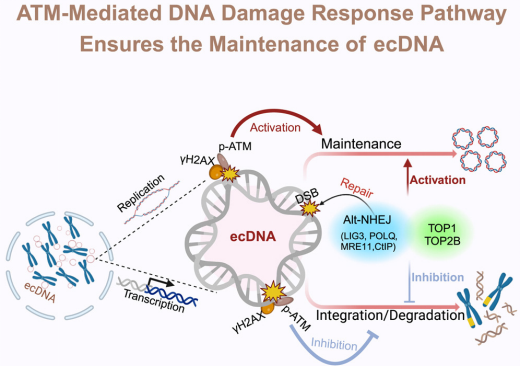
研究之初,团队面临的首要挑战是缺乏合适的细胞模型。为解决这一问题,他们巧妙地运用 CRISPR 技术,构建了两种 ecDNA 阳性(ecDNA+)细胞模型。这两种模型使得研究人员能够直接观察 ecDNA 在细胞内的行为,并与不含 ecDNA 的细胞进行严格比较。
通过先进的分子生物学技术,研究团队发现 ecDNA 在 ecDNA+ 细胞中能够自主复制,并且这一过程会激活 ATM 介导的 DNA 损伤应答(DDR)途径。更具体地说,ecDNA 的复制和转录活动显著提高了细胞内的 DNA 复制速度,这种高速复制导致 DNA 拓扑结构发生变化,形成拓扑异构酶-DNA 复合物(TOPCCs)。然而,部分 TOPCCs 无法正常解离,最终导致 DNA 双链断裂(DSB)。这些 DSB 激活了 DDR 途径,使得细胞能够感知并响应 DNA 损伤。
研究团队进一步探索了 ecDNA 的维持机制。他们发现,ecDNA 的维持需要 DDR,尤其是 alt-NHEJ 途径。这一途径涉及一系列关键蛋白,如 LIG3 和 POLθ,它们在修复 DSB 方面发挥着至关重要的作用。通过一系列实验,研究人员证实,抑制 alt-NHEJ 途径中的关键因子(如 LIG3)会破坏 ecDNA 的环化过程,导致 ecDNA 水平显著下降。
2.AI助力攻克阿尔茨海默病!Cell:人工智能揭示基因PHGDH才是阿尔茨海默病的病因,并确定一种潜在的药物化合物
DOI: 10.1016/j.cell.2025.03.045
阿尔茨海默病(AD),这种在65岁以上人群中发病率高达11%的疾病,正逐渐成为全球健康的重大挑战。然而,目前的治疗方法却十分有限,大多数患者都患有病因不明的“自发性阿尔茨海默病”。近期,加州大学圣地亚哥分校的研究团队在《Cell》杂志上发表了一项突破性研究,揭示了磷酸甘油酸脱氢酶(PHGDH)基因在阿尔茨海默病中的关键作用,并借助人工智能技术找到了一种潜在的治疗方法。
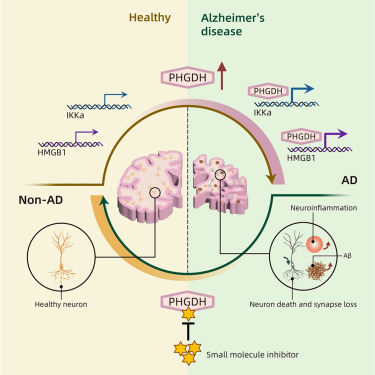
PHGDH基因编码的酶是合成丝氨酸的关键,而丝氨酸是一种与神经功能密切相关的氨基酸。研究发现,PHGDH在阿尔茨海默病患者大脑中的表达水平与病情严重程度高度相关。高水平的PHGDH与认知能力下降密切相关,且在疾病的早期阶段就出现明显变化。然而,PHGDH作为代谢酶的功能似乎并不能解释其与阿尔茨海默病的直接关联,这使得研究团队开始思考:PHGDH是否还有其他未知的生物学功能在其中起作用?
研究团队采用了两种主要的实验模型:一是转基因小鼠模型,包括3xTg-AD(携带三种与阿尔茨海默病相关的突变基因的小鼠)和5XFAD(携带APP和PSEN1突变的小鼠),这些小鼠会自然发展出类似人类阿尔茨海默病的病理特征;二是人体大脑类器官(Brain Organoids,BOs),通过诱导多能干细胞技术培养出的三维脑组织模型。
在小鼠实验中,研究者通过腺相关病毒(AAV)介导的基因编辑技术,将PHGDH在星形胶质细胞中过表达或敲低,观察对阿尔茨海默病病理特征的影响。结果显示,过表达PHGDH的小鼠大脑中β-淀粉样蛋白(Aβ)水平显著升高,而敲低PHGDH则降低了Aβ水平。
3.Cell:挑战常规!发现全新的药物摄取策略,有潜力引起药物开发领域的新变革
DOI: 10.1016/j.cell.2025.03.036
在一项新的研究中,由德克萨斯大学圣安东尼奥分校健康科学中心药理学系的Hong-yu Li教授和来自杜克大学和阿肯色大学医学科学院的研究人员领导的一个研究团队发现了大分子药物和极性药物的细胞摄取机制,并设计了一种化学内吞药物化学(chemical endocytic medicinal chemistry)的新策略来优化药物输送到细胞中的能力。这一发现可能会彻底改变未来内吞药物(endocytic drug)的设计和开发方式。相关研究结果发表在Cell杂志上。
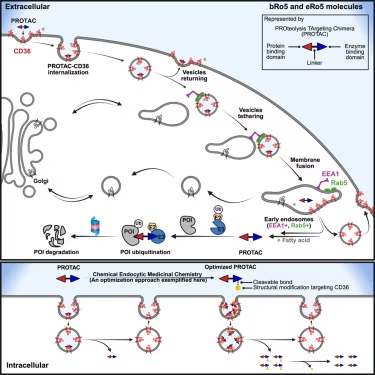
在这个新的过程中,药物分子被设计成更好地与CD36结合,其中CD36是一种在许多细胞表面发现的蛋白受体。通过优化与CD36的化学相互作用,该团队能够增强CD36的天然功能,从根本上增加了更大和极性药物化合物进入细胞的途径。
德克萨斯大学圣安东尼奥分校健康科学中心医学院院长Robert A.Hromas医学博士说,“这种创新的化学方法有可能使任何静脉注射药物都能口服。它还可以促进任何药物跨越血脑屏障。这将显著增加我们治疗脑癌症或痴呆症的药物数量。”
DOI:10.1016/j.cell.2025.01.041
近日,一篇发表在国际杂志Cell上题为“A deep learning strategy to identify cell types across species from high-density extracellular recordings”的研究报告中,来自贝勒医学院等机构的科学家们通过研究有望利用AI技术成功解码机体小脑的神经信号,从而为理解大脑如何控制运动开辟新的道路,这一成果不仅为小脑神经信号的解码提供了新的方法,也为整个脑科学领域带来了新的希望和机遇。
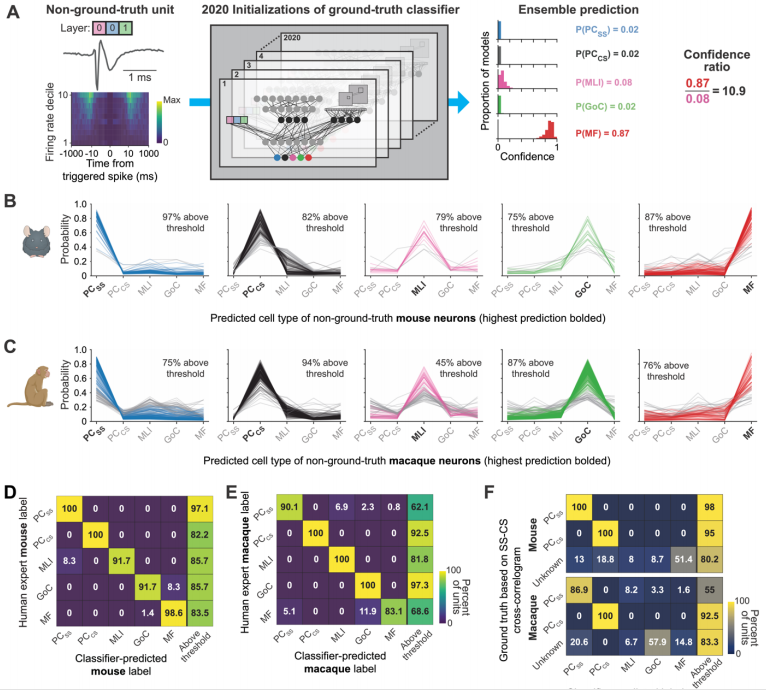
揭示来自老鼠和猴子的专家分类数据集的真值分类器性能
小脑是一种位于大脑后部、形似蝴蝶的结构,其在维持机体平衡、协调运动和调节肌肉张力等方面发挥着至关重要的作用。当我们进行任何一项运动,无论是简单的行走、拿东西,还是复杂的舞蹈、体育运动,小脑都在背后默默工作从而确保机体的动作准确无误;然而尽管科学家们已经能够记录小脑神经元的电活动,但对于这些神经信号如何在小脑内部被处理和转换从而产生精确的运动指令,却一直知之甚少,这就好比我们能听到一场热闹的聚会中的谈话声,但却无法分辨出谁在说话及他们究竟在讨论什么。
为了解决这一难题,研究人员开发了一种半监督深度学习分类器,这种分类器能根据神经元的电活动特征准确地识别出小脑中不同类型神经元的活动。这一成果的取得离不开科学家们多年来对小脑结构和功能的深入研究,及其神经科学和人工智能领域的跨学科合作。文章中,研究人员选择了小鼠和猕猴作为实验对象,利用高密度多接触记录探针(Neuropixels)同时记录数百个神经元的电活动。实验中,研究人员首先通过光遗传学技,将光敏感蛋白基因导入特定类型的神经元,从而使得这些神经元在受到光刺激时能产生可检测的电活动。随后,他们结合药物阻断技术来确保光刺激直接激活目标神经元,而非通过突触连接间接激活;通过这种方式,科学家们成功标记了小脑中不同神经元类型的电活动特征,并构建了一个包含各种神经元电生理特征的数据库。
5.Cell:科学家揭秘人类血管类器官发育过程中的细胞状态转变和命运决定机制
Doi:10.1016/j.cell.2025.03.037
近日,一篇发表在国际杂志Cell上题为“Fate and state transitions during human blood vessel organoid development”的研究报告中,来自苏黎世联邦理工学院等机构的科学家们通过研究揭示了人类血管类器官(hBVOs)的神秘面纱,并探索其在疾病建模和再生医学中的巨大潜力。

血管疾病是全球范围内的主要健康威胁之一,其复杂性在于血管系统在人体内扮演着至关重要的角色。从营养物质的运输到废物的排出,血管的健康直接关系到整个身体的正常运转。然而,研究血管疾病的传统方法往往受限于模型的不准确性和复杂性。为了突破这一瓶颈,这项研究中,研究人员致力于开发一种能够精准模拟人类血管发育和疾病的模型系统。人类血管类器官(hBVOs)应运而生不仅能模拟血管的自然发育过程,还能为研究血管疾病提供一个高度可控的实验平台。这项研究中,研究人员核心目标是通过单细胞多组学技术全面解析hBVOs的细胞状态转变和命运决定机制,并揭示其在疾病建模和再生医学中的应用潜力。
研究者表示,他们实验的核心对象是人类血管类器官(hBVOs),其是由人类多能干细胞(hPSCs)分化而来的三维结构,其能模拟血管的发育过程。首先研究人员利用单细胞RNA测序(scRNA-seq)技术对hBVOs在不同发育阶段的细胞进行详细地转录组分析,通过这种方法,他们就能追踪细胞从多能干细胞到成熟内皮细胞和壁细胞的分化路径;此外,为了深入理解基因调控网络,研究人员还结合单细胞染色质可及性测序(scATAC-seq)揭示了基因表达调控的分子机制。实验过程中,研究人员巧妙地利用了CRISPR-Cas9基因编辑技术对多个关键基因进行了敲除实验,旨在评估这些基因在血管细胞命运决定中的作用。通过这些综合手段,他们构建了一个全面的hBVOs细胞状态图谱,并揭示了多个关键转录因子和信号通路在血管发育中的调控作用。
7.Cell:震惊!首次发现肠道微生物释放抗癌胆汁酸,阻断雄激素信号传导,从而增强T细胞的癌症杀伤能力
DOI: 10.1016/j.cell.2025.02.029
威尔康奈尔医学院研究人员领导的一项临床前研究表明,人类肠道中天然存在的细菌(称为肠道菌群)可以将胆固醇衍生的胆汁酸转化为强大的代谢产物,从而通过阻断雄激素信号传导来自增强抗癌免疫力。相关研究结果发表在Cell杂志上。
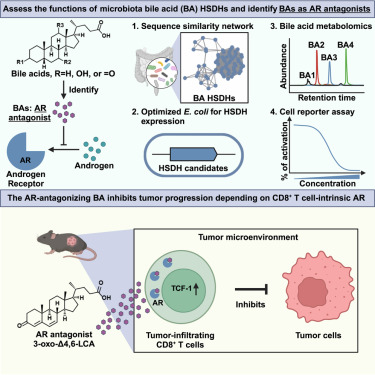
论文共同通讯作者、威尔康奈尔医学院胃肠病与肝病学系医学免疫学副教授Chun-Jun Guo博士说, “我对我们的发现感到非常惊讶。据我所知,以前没有人发现像这些胆汁酸这样的分子可以以这种方式与雄激素受体相互作用。”
当研究人员测试他们发现的56种改变的胆汁酸时,他们发现了一种拮抗雄激素受体的胆汁酸,其中雄激素受体是一种与性激素相互作用以调节人类发育许多方面的分子。当他们测试了另外44种先前已被表征的微生物群修饰胆汁酸时,他们发现另外三种作用相似。
除了在发育中的作用外,雄激素受体还存在于某些免疫细胞中,包括CD8 T细胞。先前的研究表明,阻断这种受体可以增强这些免疫细胞对抗肿瘤的能力。研究人员想知道这些胆汁酸是否可以通过结合并灭活雄激素受体来重现这种效应。
8.二十年磨一剑!Cell突破性研究:表达天然TCR的CAR-T细胞能特异性地靶向癌细胞,且不会影响健康组织
DOI: 10.1016/j.cell.2025.03.017
在癌症治疗领域,一场跨越二十年的科学接力正酝酿着革命性突破。在一项新的研究中,来自蒙特利尔大学和美国国家癌症研究所等研究机构的研究人员成功地创造了更有效的免疫细胞,可以在不损害健康组织的情况下对抗癌症。相关研究结果发表在Cell杂志上。
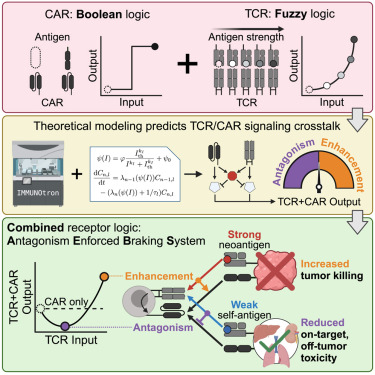
研究团队整合Altan-Bonnet实验室的高通量机器人平台(单日可分析>104个T细胞-靶细胞互作事件)与François教授团队的多尺度数学模型,首次揭示T细胞受体(TCR)的双向调控奥秘:"TCR不仅是免疫应答的加速踏板,更可化身精准刹车系统。"
在实验室中,通过添加合成嵌合抗原受体(CAR)对T细胞进行修饰。这种受体促使T细胞主动破坏癌细胞,尽管其识别肿瘤的机制不是很精确,因此经过修饰的T细胞也经常攻击健康组织。
François教授解释道,“CAR-T细胞攻击卵巢肿瘤,但也会破坏患者的健康组织,尤其是肺部。因此当它们在攻击癌症的同时,引发的过度反应或会杀死患者。”
9.Cell:科学家揭秘先天基因密码如何影响癌症发展?有望开启精准医疗新时代
DOI:10.1016/j.cell.2025.03.026
在癌症研究领域,我们常常会听到“基因突变”这个词,但你知道吗?除了后天发生的基因突变,我们从出生时就携带的先天基因(即生殖系基因)也在癌症的发生和发展中扮演着关键角色;这些先天基因变异就像隐藏在我们身体里的“密码”,悄无声息地影响着细胞的功能,甚至决定了癌症的形成、演变和对治疗的反应。
近日,一篇发表在国际杂志Cell上题为“Precision Proteogenomics Reveals Pan-Cancer Impact of Germline Variants”的研究报告中,来自西奈山伊坎医学院等机构的科学家们通过研究首次揭示了这些先天基因变异对癌症的深远影响,有望为未来的癌症治疗带来新的曙光。
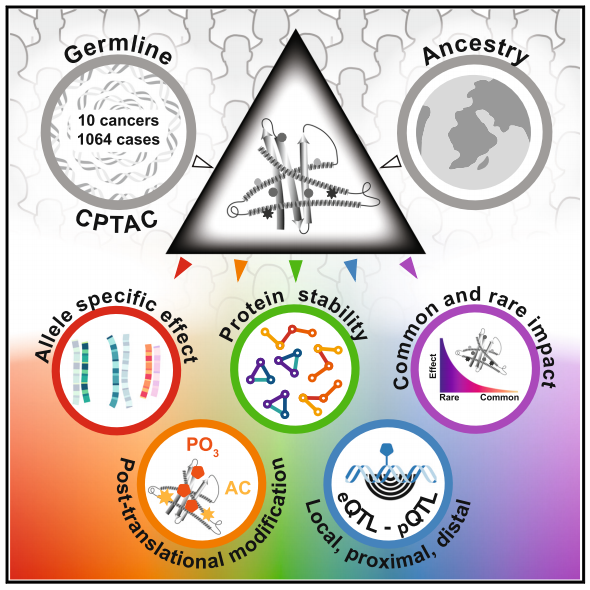
这项研究中,研究人员分析了超过1000名患者的样本,共涵盖10种不同的癌症类型,他们发现,先天基因变异不仅影响蛋白质的结构和稳定性,还会改变基因表达,甚至影响肿瘤与免疫系统的相互作用。通过一种名为“精准肽组学”的先进技术,研究团队对超过33万个编码蛋白质的先天基因变异进行分析揭示了这些变异如何在肿瘤中发挥作用。
这项研究不仅关注肿瘤本身的基因突变,还深入探讨了患者先天基因背景对癌症的影响,这种全面的视角为个性化癌症治疗提供了新的思路。比如,在癌症免疫治疗中,为什么有些患者对免疫疗法反应良好,而另一些患者却没有反应?先天基因差异或许就是关键因素之一,此外,通过分析先天基因变异,研究人员正在开发新的计算模型用于预测肺癌风险,这或许就能帮助确定哪些人最需要进行早期筛查,从而通过早期发现改善患者的治疗效果。
10.两篇Cell 揭秘细胞因子与大脑的“爱恨情仇”!免疫系统中的细胞因子不仅能指挥免疫细胞对抗病原体,还能影响我们的情绪和行为
DOI: 10.1016/j.cell.2025.03.005; DOI: 10.1016/j.cell.2025.03.006
最近,“精神内耗”“社恐”“焦虑症”成了全网热词。年轻人一边在社交媒体上玩梗自嘲,一边默默下单褪黑素和抗抑郁药物。但你可能不知道,这些情绪问题可能和你的免疫系统有直接关系——是的,那个平时负责“打病毒怪兽”的免疫系统,居然偷偷给大脑发“骚扰短信”!

近年研究发现,免疫细胞释放的细胞因子(一种信号分子)不仅能指挥免疫反应,还能直接“入侵”大脑,像调音师一样拨动神经回路的开关。比如银屑病患者在接受抗炎治疗后,皮肤症状缓解了,却莫名出现焦虑加重;自闭症小鼠注射特定细胞因子后,社交能力突然“开挂”。这些现象背后,是免疫系统和神经系统的“跨界合作”还是“相爱相杀”?
2025年4月,两项发表于《Cell》的研究几乎同步发表,揭示了一个令人震惊的事实:炎症因子 IL-17A、IL-17C,甚至 IL-17E,不仅穿过血脑屏障,还能精准锁定大脑中的关键神经元,从而调控我们的焦虑和社交行为。
研究人员通过两项系统性的动物实验,发现一种名为IL-17的免疫分子,不但能引发免疫反应,还能直接作用于控制情绪与社交行为的大脑区域。这一发现或许能解释,为什么一些治疗皮肤病、类风湿等的抗炎药,会意外地让人焦虑甚至抑郁。这一发现,为我们理解精神疾病的免疫机制提供了重要线索。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


