《癌症通讯》:曹雪涛/王春梅/徐瑞华课题组合作,发现影响胃癌免疫治疗的关键位点!
来源:奇点糕 2023-08-11 15:07
研究者们在论文中表示,本次研究初步提示了MFSD2A作为胃癌免疫治疗预测性生物标志物,以及增敏免疫治疗靶点的价值,但后续仍需进一步分析MFSD2A更适合单独使用还是联合应用
近期,中国医学科学院/北京协和医学院曹雪涛、王春梅课题组及中山大学肿瘤防治中心徐瑞华课题组,在Cancer Communications期刊发表了一项最新研究成果,揭示了可能对胃癌免疫治疗有重要调节作用的靶点——MFSD2A。
研究显示,MFSD2A可通过抑制环氧化酶2(COX2)-前列腺素合成,阻断胃癌细胞释放TGFβ1,从而使胃癌肿瘤微环境重编程,促进CD8+T细胞激活并减少其耗竭,胃癌中过表达MFSD2A可增强PD-1抑制剂的疗效。因此,MFSD2A有望作为预测晚期胃癌免疫治疗效果的生物标志物,乃至理想的联合治疗靶点[1]。

论文首页截图
MFSD2A此前被阐明的主要生理作用,是在血脑屏障上作为转运蛋白负责运送脂质,直到2010年才有研究提出,MFSD2A可能通过调节细胞周期和细胞外基质附着发挥抑癌作用[2],后来又有研究认为MFSD2A与人体应对外来感染时的CD8+T细胞记忆功能维持有关[3],但它这次是头一回牵涉进抗肿瘤免疫。
我国研究者们能把MFSD2A“揪出来”,则是通过单刀直入式的研究方法:研究者们分析了国产PD-1抑制剂特瑞普利单抗用于难治性晚期胃癌的一项临床I/II期研究中,共27例疗效可评估患者的活检样本,用RNA测序法评估应答不同患者(即部分缓解/PR和疾病进展/PD)的组织转录组学差异。
在代谢通路KEGG分析中,MFSD2A正是PR患者组织样本中,较PD患者上调最显著的代谢相关基因。研究者们又分析了149例胃癌组织和正常临近组织样本,发现胃癌组织中的MFSD2A表达明显偏低,且与患者临床分期呈负相关。
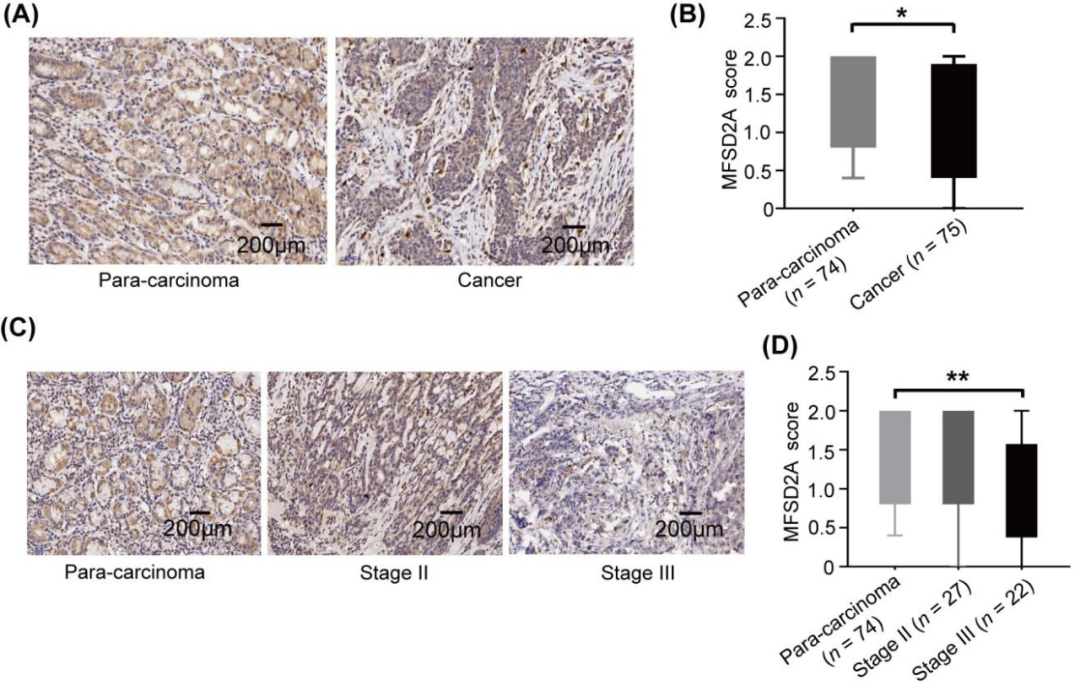
胃癌组织中MFSD2A表达低于正常组织,且与患者临床分期呈负相关
这些迹象都表明,MFSD2A可能与胃癌微环境中的免疫应答状态有关,于是研究者们继续开展小鼠实验,首先证实单纯的MFSD2A过表达,就可显著抑制胃癌生长,而在MFSD2A过表达小鼠中,PD-1抑制剂对胃癌的抑制作用也显著更强。
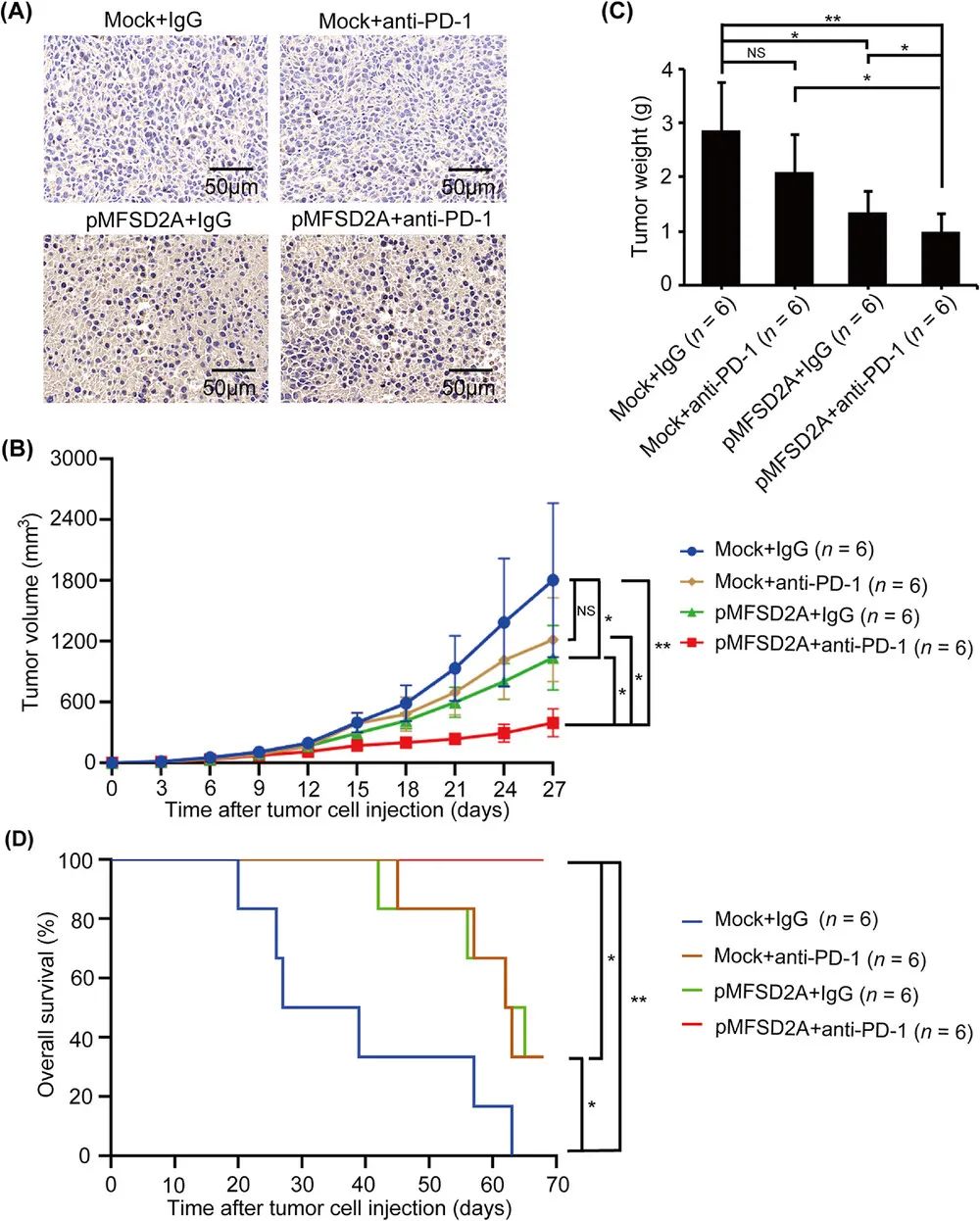
MFSD2A过表达可显著抑制胃癌,并增强PD-1抑制剂的作用
对胃癌微环境中免疫细胞组分的分析则显示,MFSD2A过表达可使CD8+T细胞及其它T细胞亚群(如CD3+等)浸润增多,而不利于抗肿瘤免疫应答的M2型肿瘤相关巨噬细胞(TAMs)则显著减少,与PD-1抑制剂处理的效果相似。
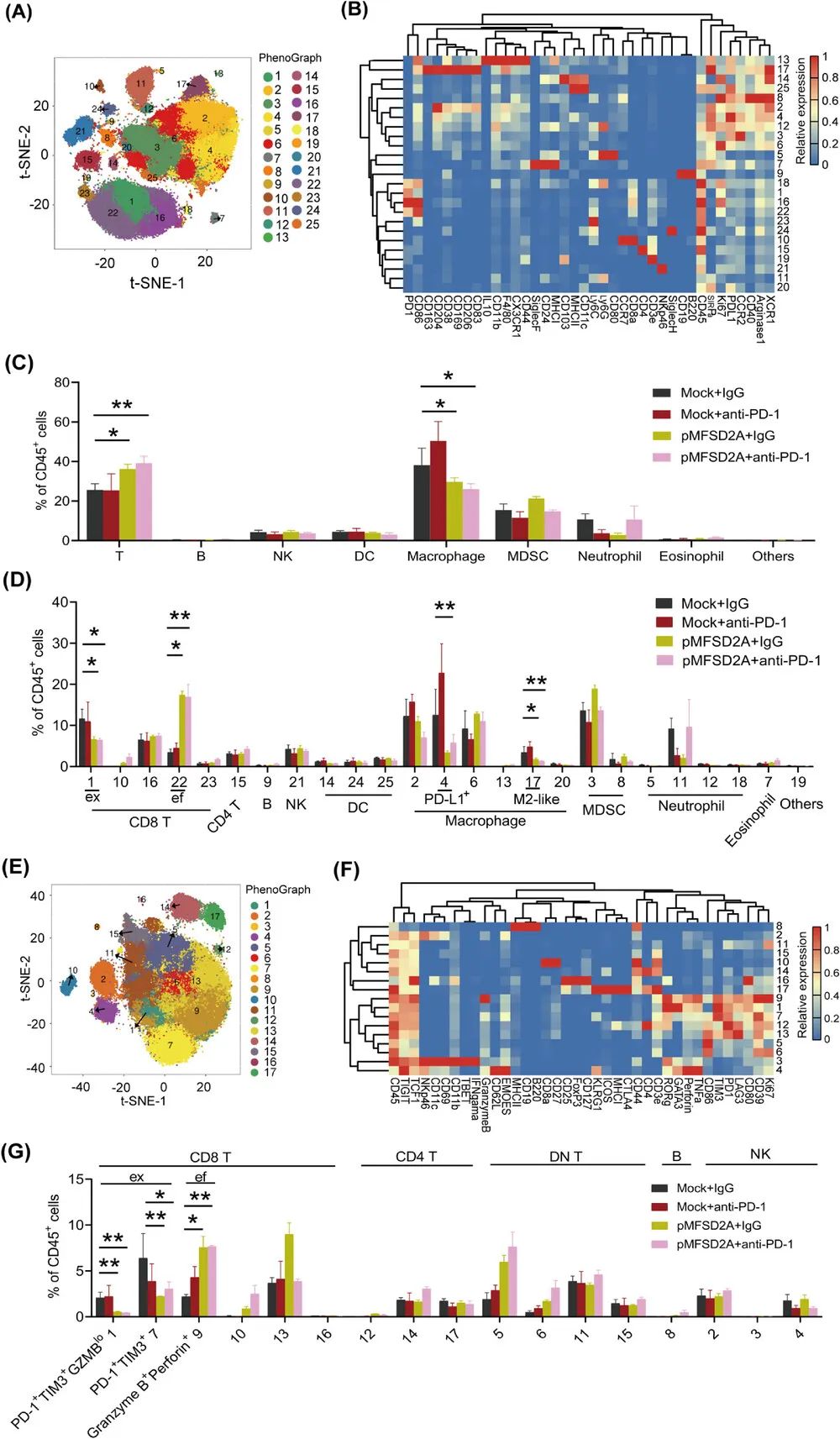
MFSD2A过表达可重塑肿瘤微环境中的免疫细胞组分
清除掉CD8+T细胞后,单纯的MFSD2A过表达就不能再增强抗肿瘤免疫应答,说明MFSD2A过表达的作用需要依赖CD8+T细胞实现;且在MFSD2A过表达小鼠中的CD8+T细胞,也会分泌更多的颗粒酶B和IFN-γ,提示更强的细胞毒性作用,沉默MFSD2A表达则使CD8+T细胞的细胞毒性减弱。
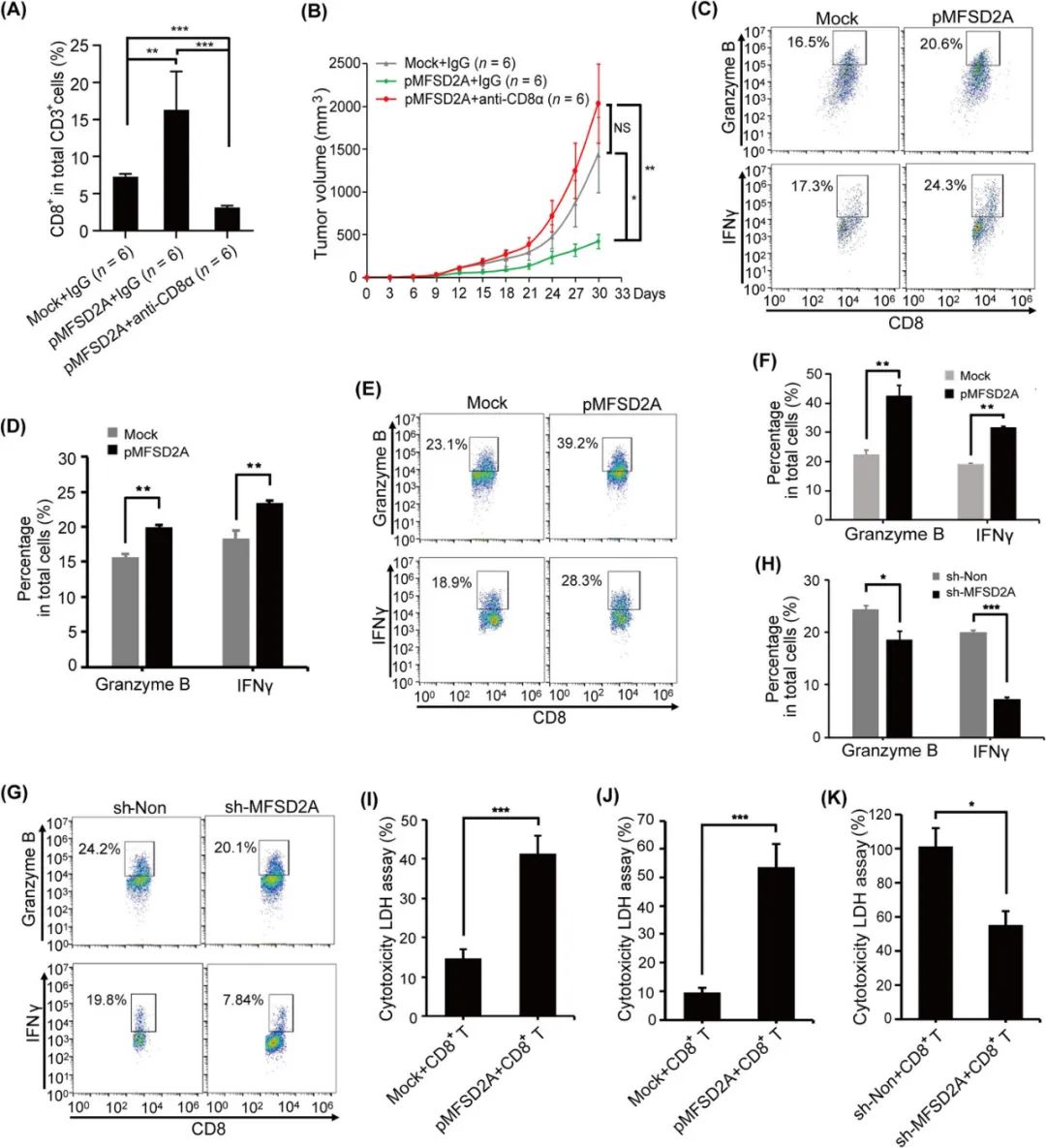
MFSD2A过表达可增强CD8+T细胞的细胞毒性
此外,转录组学分析显示在沉默MFSD2A基因表达后,胃癌细胞会分泌更多的免疫抑制因子TGFβ1,其它免疫抑制因子并不受明显影响,MFSD2A是通过抑制COX2-前列腺素轴介导的TGFβ1合成起到这种效应;而使用TGFβ1抑制剂(Disitertide),即可逆转MFSD2A缺陷造成的CD8+T细胞功能受限。
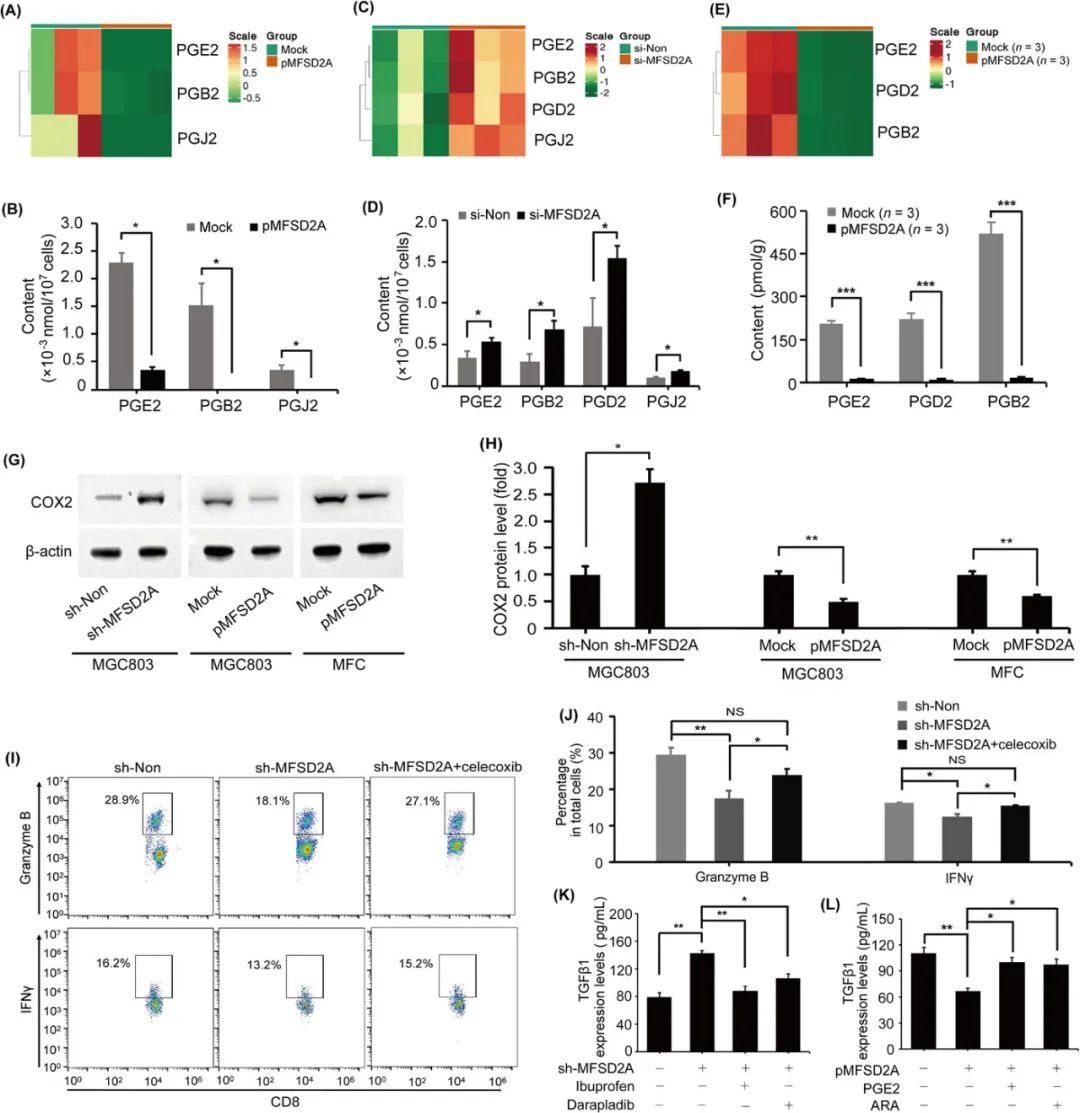
MFSD2A通过抑制COX2-前列腺素轴,减少TGFβ1合成
研究者们在论文中表示,本次研究初步提示了MFSD2A作为胃癌免疫治疗预测性生物标志物,以及增敏免疫治疗靶点的价值,但后续仍需进一步分析MFSD2A更适合单独使用还是联合应用,而COX2-前列腺素轴对CD8+T细胞功能的影响,则反映出前列腺素代谢通路的意义不容低估,值得后续探索。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


