研究人员开发基于单分子测序平台的单细胞多组学测序技术
来源:网络 2023-10-03 19:20
单细胞多组学测序技术是指对一个单细胞同时检测多个组学层面(例如基因组、表观基因组和转录组)的测序技术。这类技术可以更系统、全面地探索细胞异质性以及同一个细胞内的不同组学层面之间的互动关系,有利于更深入
单细胞多组学测序技术是指对一个单细胞同时检测多个组学层面(例如基因组、表观基因组和转录组)的测序技术。这类技术可以更系统、全面地探索细胞异质性以及同一个细胞内的不同组学层面之间的互动关系,有利于更深入地解析复杂的生理、病理过程中细胞类型特异性的分子调控机制1, 2。2019年,Nature Methods杂志将单细胞多组学技术评为年度技术3。
DNA甲基化作为一种表观遗传标记,在生物发育和肿瘤发生等生物学过程中发挥着重要作用。自从1992年以来,亚硫酸氢盐(bisulfite)测序一直是DNA甲基化测序的金标准4。2012年,Benjamin P. Berman和Peter A. Jones团队基于亚硫酸氢盐转化,细胞内源DNA甲基化通常发生在CpG位点的特点,以及DNA甲基转移酶M.CviPI具有对处于开放染色质区域的GpC位点进行特异性甲基化的特点,开发了能够用来同时检测基因组(拷贝数变异)、DNA甲基组、染色质状态组的NOMe-seq技术1。在此基础上,北大生物医学前沿创新中心汤富酬课题组和其他课题组分别开发了scCOOL-seq5和scNMT-seq6等单细胞多组学测序技术,能够在单个细胞内同时检测基因组(拷贝数变异)、DNA甲基组、染色质状态组以及转录组。
然而,目前人们对单个细胞内表观基因组及其与转录组之间的互动关系的了解主要来自二代测序平台(next generation sequencing, NGS),测序读长通常为300bp。在生理或病理条件下,不同的表观基因组层面(例如DNA甲基化与染色质状态)之间常常在相对较长的基因组区域内相互作用7, 8。近年来,伴随着测序技术的发展,基于Oxford Nanopore或PacBio SMRT的三代测序平台(third generation sequencing, TGS,也称为单分子测序平台)均能进行高通量长读长测序,为长片段DNA上的表观遗传修饰的研究带来了新的机遇。2022年,Nature Methods杂志将长读长测序技术评为年度技术9。
涉及亚硫酸氢盐转化处理的DNA甲基化测序方法(例如BS-seq)往往会导致DNA片段的断裂和降解,因而无法获得较长的DNA片段。2020年,Winston Timp团队结合Nanopore测序平台能够直接检测DNA分子上甲基化修饰的特点和NOMe-seq的测序原理,研究开发出了NanoNOMe这一大量细胞样本(bulk sample)的多组学测序方法,可在较长的染色质区域同时分析内源性DNA甲基化以及染色质可及性10。该方法需要0.5—1μg基因组DNA作为起始材料,不适用于胚胎等珍贵样品以及肿瘤等具有高度细胞异质性的样品。人类单个二倍体细胞的基因组DNA仅有6pg左右,因此单细胞测序技术往往需要PCR扩增,而PCR扩增会导致扩增产物丧失DNA修饰信息。基于三代测序平台的单细胞多组学测序技术仍然有待开发,与此同时,单细胞分辨率下不同层面表观遗传信息的长距离调控规律也有待进一步探索。
2023年9月12日,汤富酬课题组在Cell Research上发表了题为“scNanoCOOL-seq: a long-read single-cell sequencing method for multi-omics profiling within individual cells”的论文,首次报道了名为scNanoCOOL-seq的单细胞多组学测序技术。该技术整合了三代测序平台(单分子测序平台)和scCOOL-seq原理,能够实现在一个单细胞中同时精准检测基因组(拷贝数变异)、DNA甲基化组、染色质可及性以及转录组等多个组学层面的信息。

论文截图
scNanoCOOL-seq技术主要采用亚硫酸氢盐转化和单接头PCR扩增的策略,最终获得长度约为900bp的基因组DNA扩增片段。如下图所示,scNanoCOOL-seq技术的实验流程主要包括:1)通过温和的方式进行细胞裂解和体外M.CviPI酶加甲基化后,进行单细胞的核质分离;2)单细胞的细胞核部分经过亚硫酸氢盐处理和类PBAT策略的单接头扩增后用于Nanopore平台的单分子测序;3)单细胞的细胞质部分用于scRNA-seq文库构建(优化的STRT-seq)后进行转录组检测(图1)。利用K562和HFF1这两个人类细胞系,该研究证实了scNanoCOOL-seq能够精准检测单个细胞的DNA甲基化组(图2a, b)、染色质可及性(图2a, c)以及基因组(拷贝数变异)(图2d),其检测准确性与基于二代测序平台的scCOOL-seq技术相当,但是测序读长从原来的300bp增加到900bp。
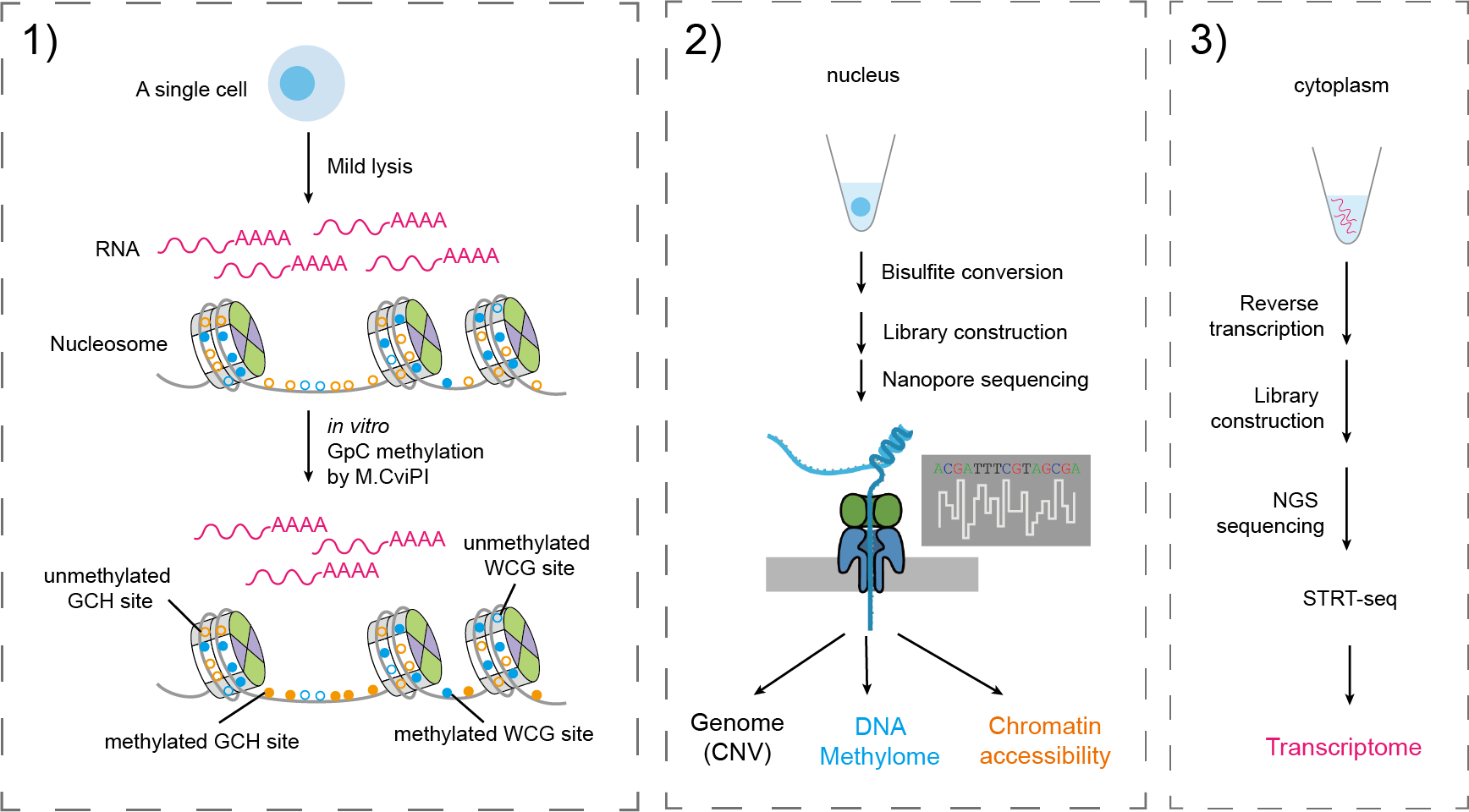
图1. scNanoCOOL-seq技术的实验流程图
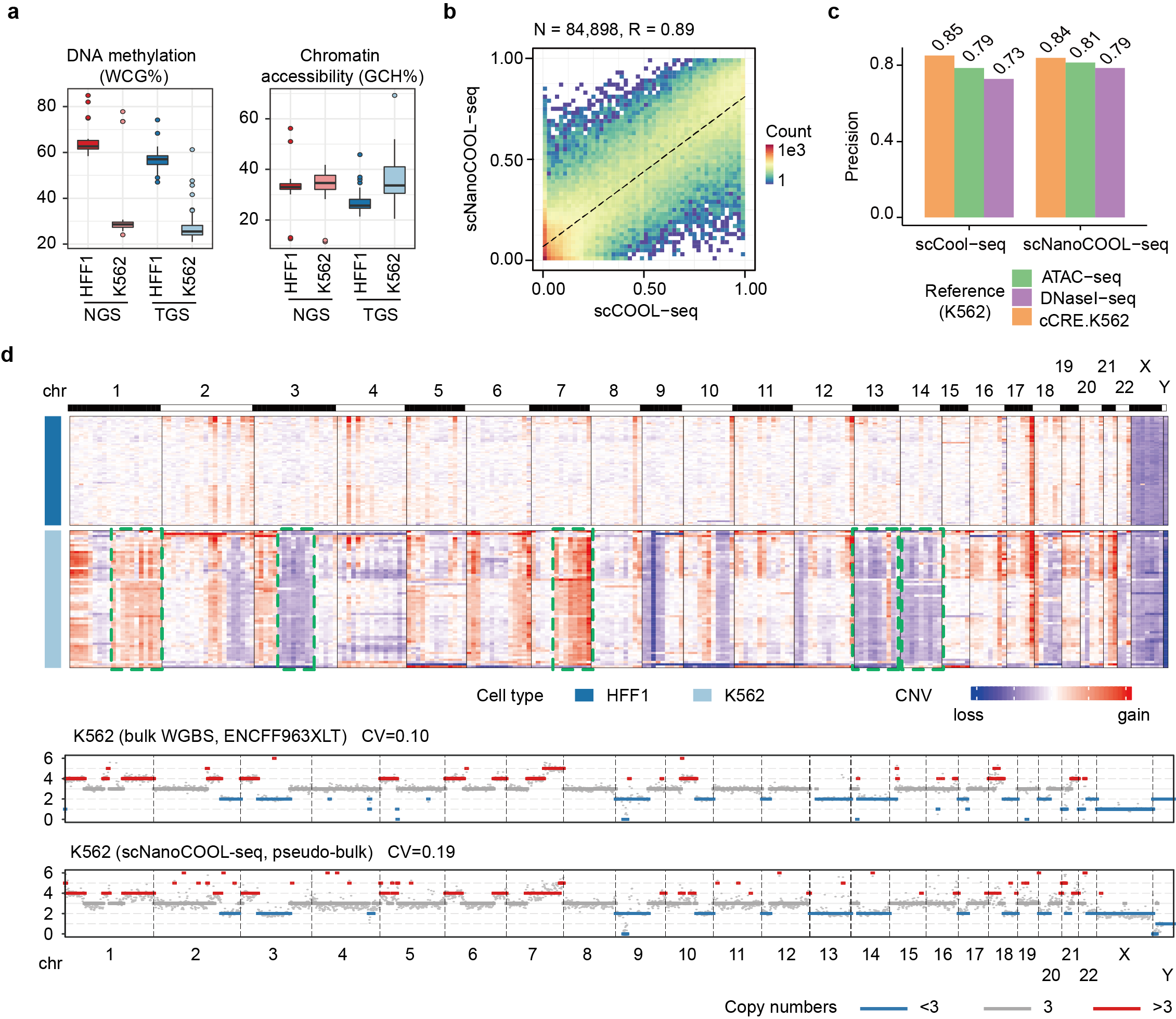
图2. scNanoCOOL-seq技术的检测性能
该研究在多个方面对scNanoCOOL-seq技术的应用进行了探索:
1. scNanoCOOL-seq能够在单个细胞中以单分子分辨率精准检测DNA甲基化以及染色质可及性等表观遗传特征
相对于scCOOL-seq,scNanoCOOL-seq在长读长方面的优势主要包括以下两点:1)数据显示,人类基因组中的CpG岛(CpG island, CGI)的中位数长度为575bp。基于二代测序平台的测序数据(通常双端300bp)往往无法在单分子水平完全覆盖整个CpG岛。而作为重要的调控元件,从单分子水平完整检测CpG岛中的DNA甲基化修饰有利于更好地研究CpG岛甲基化对基因表达的调控作用。该研究证实基于三代测序平台的scNanoCOOL-seq能够在每个单细胞中完整覆盖数百个CpG岛和基因启动子区域,当单细胞数量增加至400个左右时被完整覆盖的CpG岛和基因启动子数量增加至总数的90%左右(图3a, b);2)基于二代测序平台的测序方法难以用于检测基因组中的复杂结构变异(structural variations, SVs),如染色体易位等基因组区域的表观遗传修饰。该研究发现基于三代测序平台的scNanoCOOL-seq可以在单分子分辨率准确检测K562细胞中由于染色体易位导致的BCR-ABL1融合基因以及相应的野生型等位基因的DNA甲基化以及染色质可及性特征(图3c)。另外,scNanoCOOL-seq也能精准检测印记基因的印记调控区域的亲本特异性DNA甲基化模式(图3d)。

图3. scNanoCOOL-seq以单分子分辨率检测全长CpG岛、基因启动子、染色质易位事件的表观遗传特征及亲本特异性DNA甲基化
2. scNanoCOOL-seq能够精准检测细胞中DNA甲基化动态变化以及染色质可及性的异质性
5-氮杂胞嘧啶(5-aza)是一种常见的去甲基化药物。该研究以5-氮杂胞嘧啶处理K562细胞作为生物学模型探究scNanoCOOL-seq在检测DNA甲基化和染色质可及性的动态变化和异质性上的能力(图4a)。结果表明,与预期相符,在经过5-氮杂胞嘧啶连续5天处理的K562细胞中DNA甲基化水平持续下降,而在对照组K562细胞中DNA甲基化水平维持不变(图4b, c)。不仅如此,在经过5-氮杂胞嘧啶处理后K562细胞的全基因组DNA甲基化呈现出异质性增加的趋势(图4d)。为研究K562细胞响应去甲基化药物后基因表达模式的动态变化,该研究进行了拟时间分析和功能富集分析。结果显示,K562细胞在响应5-氮杂胞嘧啶处理过程中,表达水平下调的基因主要富集在细胞器分裂、染色体分离、核糖体生物合成、rRNA代谢过程和rRNA加工等生物学过程,而表达水平上调的基因主要是与白细胞趋化、免疫细胞增殖和激活等相关的基因。
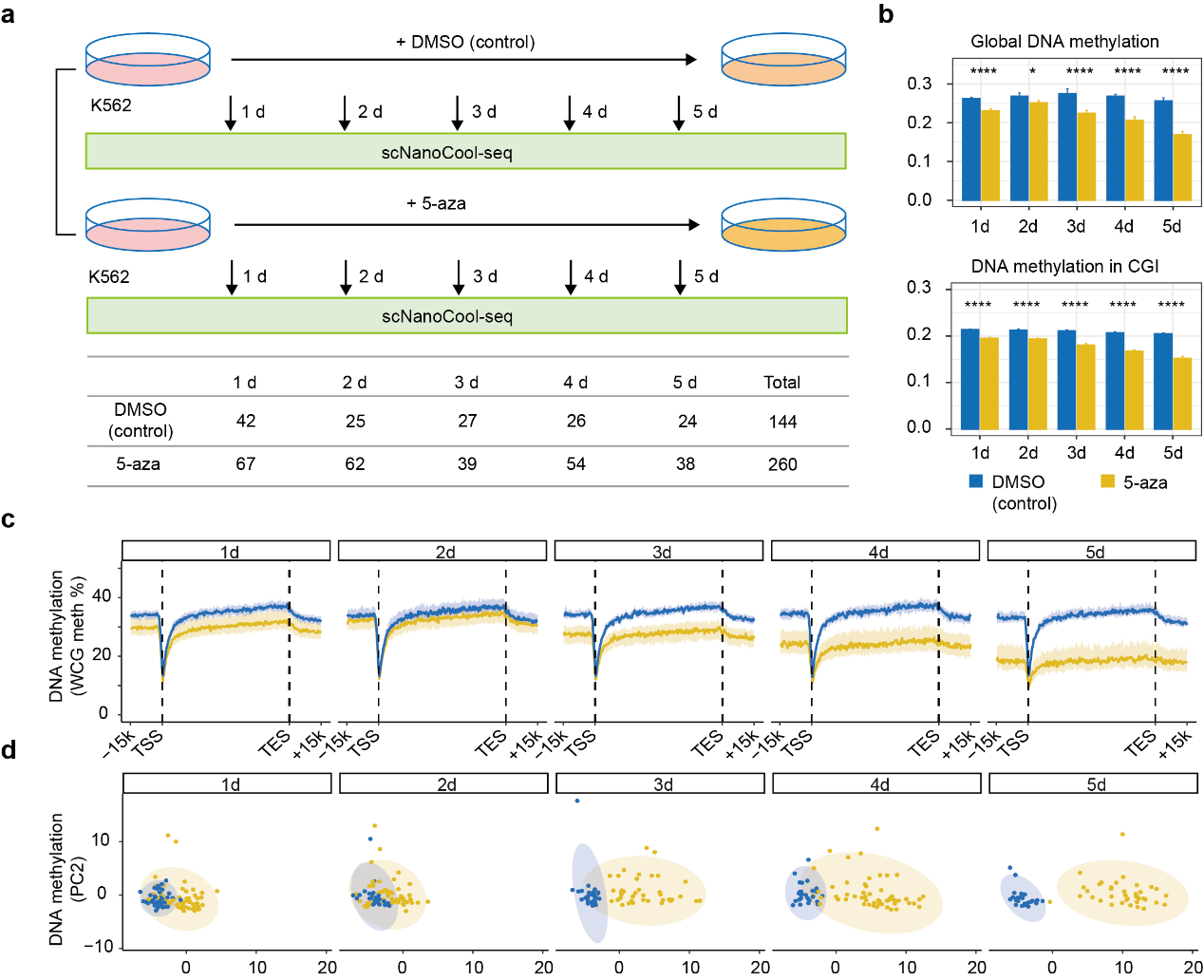
图4. scNanoCOOL-seq检测K562细胞响应去甲基化药物后的动态变化和异质性
3. scNanoCOOL-seq能够精准刻画小鼠囊胚发育过程中表观基因组中的细胞谱系特异性特征
哺乳动物在着床前发育过程中经历了显著且关键的表观遗传重编程和细胞命运决定11。第一次细胞命运决定时早期囊胚分化成多能性内细胞团(inner cell mass, ICM)和滋养外胚层(trophectoderm, TE)。第二次细胞命运决定发生时晚期囊胚阶段的内细胞团细胞进一步分化为上胚层(epiblast,Epi)和原始内胚层(primitive endoderm,PrE)(图5a)。已知在随后的发育过程中,上胚层细胞将发育成整个胚胎,而原始内胚层和滋养外胚层细胞将发育成胚外组织11。尽管已经对哺乳动物的早期胚胎发育进行了广泛的研究5, 11,仍然还没有在单细胞水平和多组学层面解析囊胚发育过程中表观基因组和转录组的动态变化以及其互动关系。
该研究利用scNanoCOOL-seq技术在单细胞分辨率下系统地描绘了小鼠囊胚期胚胎中表观基因组多个组学层面的动态变化(图5b)。该研究发现,1)在晚期囊胚(E4.5)中,原始内胚层细胞中基因体(gene body)区的DNA甲基化水平(22.8%)高于上胚层细胞(18.8%),而滋养外胚层细胞中基因体区域的DNA甲基化水平(15.1%)最低。在晚期囊胚中,滋养外胚层细胞基因体区域的平均染色质可及性水平高于上胚层和原始内胚层细胞(图5b)。2)早期雌性(XX)囊胚的内细胞团和滋养外胚层细胞中尚未完成印记式的X染色体失活(imprinted X chromosome inactivation, iXCI,父源X染色体特异性失活),而晚期雌性囊胚的原始内胚层和滋养外胚层细胞都显示出已经完成了印记式的X染色体失活。与原始内胚层和滋养外胚层细胞不同,晚期雌性囊胚的上胚层细胞中有部分父源X染色体已经重新激活,并为后续发育阶段X染色体随机失活(random X chromosome inactivation, rXCI)做好准备(图5c)。3)与上胚层细胞相比,晚期囊胚中的滋养外胚层细胞的母源基因组DNA甲基化具有更强的链偏向性和更低的DNMT1表达量,说明在滋养外胚层细胞中发生了更强烈的DNA被动去甲基化(在DNA复制过程中,DNA新生链上没有完全补上甲基化修饰)(图5d)。

图5.scNanoCOOL-seq检测小鼠囊胚不同谱系的鉴定、表观组动态变化、等位基因特异性转录组和链特异性的表观基因组
综上所述,基于单分子测序平台的scNanoCOOL-seq技术能够对一个单细胞同时进行基因组(拷贝数变异)、DNA甲基化组、染色质可及性以及转录组测序分析。利用长读长测序的优势,scNanoCOOL-seq可以检测全长CpG岛和基因启动子区域的多重表观遗传特征以及不同组学层面间的互动关系。此外,scNanoCOOL-seq还可以在单分子分辨率检测染色体易位等复杂基因组结构变异事件产生的表观遗传改变,同时也为在单个细胞中对等位基因特异性的表观遗传特征以及DNA链特异性的表观遗传特征的研究提供了强大的工具。
北京大学前沿交叉学科研究院博士生林建立、薛晓慧为该论文的并列第一作者。汤富酬为该论文的通讯作者。该研究项目得到了国家自然科学基金基础科学中心项目、科技创新2030-“脑科学与类脑研究”重大项目的资助。
参考文献:
1 Kelly TK, Liu Y, Lay FD, Liang G, Berman BP, Jones PA. Genome-wide mapping of nucleosome positioning and DNA methylation within individual DNA molecules. Genome research 2012; 22:2497-2506.
2 Pott S. Simultaneous measurement of chromatin accessibility, DNA methylation, and nucleosome phasing in single cells. Elife 2017; 6.
3 Method of the Year 2019: Single-cell multimodal omics. Nature methods 2020; 17:1-1.
4 Liu Y, Siejka-Zielinska P, Velikova G et al. Bisulfite-free direct detection of 5-methylcytosine and 5-hydroxymethylcytosine at base resolution. Nat Biotechnol 2019; 37:424-429.
5 Guo F, Li L, Li J et al. Single-cell multi-omics sequencing of mouse early embryos and embryonic stem cells. Cell Res 2017; 27:967-988.
6 Clark SJ, Argelaguet R, Kapourani C-A et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature communications 2018; 9:781.
7 Xu C, Corces VG. Nascent DNA methylome mapping reveals inheritance of hemimethylation at CTCF/cohesin sites. Science 2018; 359:1166-1170.
8 Bell AC, Felsenfeld G. Methylation of a CTCF-dependent boundary controls imprinted expression of the Igf2 gene. Nature 2000; 405:482-485.
9 Method of the Year 2022: long-read sequencing. Nature methods 2023; 20:1-1.
10 Lee I, Razaghi R, Gilpatrick T et al. Simultaneous profiling of chromatin accessibility and methylation on human cell lines with nanopore sequencing. Nature methods 2020; 17:1191-1199.
11 Wang Y, Yuan P, Yan Z et al. Single-cell multiomics sequencing reveals the functional regulatory landscape of early embryos. Nat Commun 2021; 12:1247.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


