利用RNA干扰降低CRISPR在肝脏中的脱靶性
来源:生物世界 2022-04-16 08:06
这项研究证实,可以通过抗CRISPR寡核苷酸和siRNA来减少LNP递送的CRISPR基因编辑系统在肝脏细胞中导致的脱靶编辑。
使用脂质纳米颗粒(LNP)递送的mRNA疫苗在抗击COIVD-19大流行中获得巨大成功,同时也突出了mRNA技术的医疗和社会效益。不仅如此,mRNA还可以用来诱导细胞产生外源蛋白,用于免疫治疗和基因编辑等等。
在基因编辑中,确保病变细胞中特定的目标编辑和避免改变其他非目标细胞的基因组是至关重要的。值得注意的是,通过静脉注射输送的LNP有很大一部分(30-90%)会富集在肝脏中,这阻碍了非病毒载体在肝脏以外的组织中进行编辑基因等治疗手段的发展。
近日,美国佐治亚理工学院的研究人员在 Nature Biomedical Engineering 期刊发表题为:Augmented lipid-nanoparticle-mediated in vivo genome editing in the lungs and spleen by disrupting Cas9 activity in the liver 的研究论文。
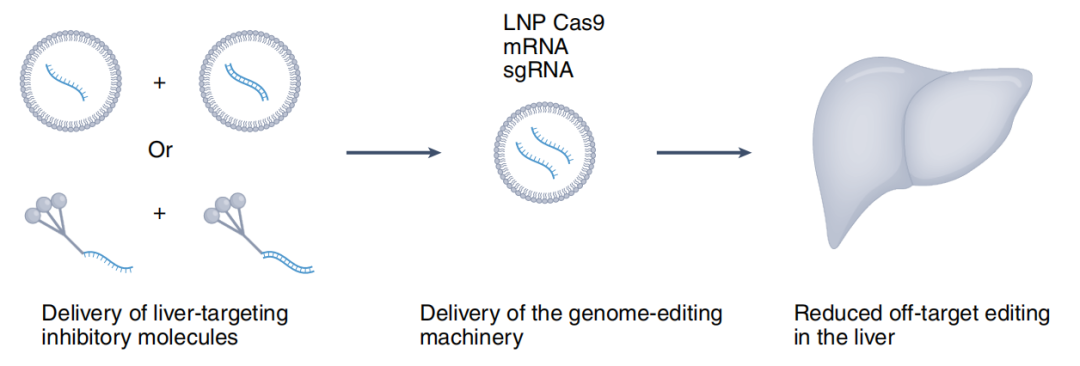
该研究表明,通过脂质纳米颗粒(LNP)将两种寡核苷酸(干扰sgRNA二级结构的寡核苷酸、靶向Cas9-mRNA的siRNA)递送到肝脏,破坏肝脏细胞中的脱靶编辑,从而提高了肝外组织和器官中CRISPR-Cas基因组编辑的特异性。
该研究的通讯作者 James Dahlman 教授及其团队首先开发出了抑制性的抗CRISPR寡核苷酸,并在小鼠主动脉内皮细胞插入突变模型中证实,该抗CRISPR寡核苷酸可以与sgRNA相互作用,减少Cas9介导的基因组编辑活性。
进一步的研究阐明了抗CRISPR寡核苷酸的作用机制:抗CRISPR寡核苷酸破坏了sgRNA的二级结构,阻止了sgRNA与Cas9的结合,从而减少了脱靶编辑。
为了研究抗CRISPR寡核苷酸是否可以用来减少肝脏中的脱靶编辑,研究团队首先给稳定表达Cas9-GFP融合蛋白的小鼠递送两种不同的LNP,一种LNP携带抗CRISPR寡核苷酸,另一种则携带无序寡核苷酸。两小时后,他们用同样的LNP处理了同样的小鼠,但却封装了靶向GFP基因位点的sgRNA。
研究团队发现,与无序寡核苷酸相比,抗CRISPR寡核苷酸将肝脏中因脱靶编辑导致的插入突变频率降低了两倍以上。
通讯作者 James Dahlman 教授表示:“在向小鼠注射LNP的前两个小时,含靶向GFP-sgRNA的抗CRISPR寡核苷酸的LNP降低了肝脏细胞的插入突变的频率,但在肺部细胞和无序寡核苷酸LNP中则没有这种效果。”
为了进一步减少脱靶基因组编辑,研究团队设计了包含5个小干扰RNA(siRNA)结合位点(在3'非翻译区域)的Cas9-mRNA,并在在永生化小鼠主动脉内皮细胞模型和小鼠模型中证实,siRNA与Cas9-mRNA的结合激活了内源性RNA干扰的细胞过程,导致mRNA降解,从而有效减少肝细胞因CRISPR基因编辑而引起的插入突变。
更重要的是,研究团队还发现,当他们将抗CRISPR寡核苷酸和siRNA联合使用后,可以进一步减少肝脏细胞中发生脱靶基因编辑。不仅如此,研究人员用另一种递送系统(GalNAc)和肺部炎症小鼠模型复制了这些发现。
总的来说,这项研究证实,可以通过抗CRISPR寡核苷酸和siRNA来减少LNP递送的CRISPR基因编辑系统在肝脏细胞中导致的脱靶编辑。在当下,大多数基因组编辑技术需要多个组件。因此,对LNP的设计进行优化,以顺序或同时传递每种成分,对治疗性体内基因组编辑在人类中的安全应用至关重要。除了基因组编辑,核酸递送还可以用来治疗癌症和其他疾病,此外,LNP通过活性或内源性靶向优先进入特定的器官和细胞类型,并可以提供多种核酸,这可能有助于基因编辑在新疾病环境中的应用。
http://meeting.bioon.com/2021Gene
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->