Developmental Cell:瘦腺-导管细胞重排以 IGF/PI3K 依赖性方式驱动小鼠胰腺的分支形态发生
来源:网络 2024-02-11 11:42
近段时间,来自英国伦敦国王学院基因治疗和再生医学中心的Jean-Francois Darrigrand教授及团队通过使用体内外小鼠模型,解释胰腺器官发生过程中尖头结构增殖和分支分叉是如何同步进行的。
许多上皮器官在发育过程中经历了分支形态发生,从而构建了复杂的树枝状网络,并获得了特化的组织结构。了解组织结构的建立和维持是发育生物学的一个核心问题,对器官的生理和疾病有直接影响。而在成人生活中,组织结构的丧失可能发生在早期阶段和各种人类癌症中。但这些过程是如何协调的,以及如何在器官发育过程中发生剧烈细胞重排的情况下保留组织结构,目前仍不清楚。
近段时间,来自英国伦敦国王学院基因治疗和再生医学中心的Jean-Francois Darrigrand教授及团队通过使用体内外小鼠模型,并发现胰腺导管细胞通过突出和拉扯尖头基底膜形成裂隙而导致的尖头分裂。胰岛素生长因子(IGF)/磷脂酰肌醇 3-激酶(PI3K)通路通过控制胰腺导管组织的流动性精细调节这一过程,同时对分支和细胞命运的获得产生影响。通过这一研究,旨在解释胰腺器官发生过程中尖头结构增殖和分支分叉是如何同步进行的。

结果显示,在胰腺发育过程中,在初级分支顶端建立分化的acini是分支分叉的先决条件。在 Jag1 基因缺陷的胰腺中,外周导管细胞并没有被适当地特化,但次级分支仍然形成,这表明,没有明确导管特征的祖细胞仍然可以触发裂隙的形成。胰腺需要基质的完整性,末端导管细胞才能受其牵引形成裂隙。因此在胰腺中,胰腺裂隙是由胰腺导管祖细胞作用于胰腺针叶区所驱动的,而在唾液腺中,胰腺裂隙则是由胰腺针叶区基于细胞-基质优先粘附的自组织机制所导致的。在分子水平上的研究发现,凋亡肯定会导致后期的分支缺陷。 PI3K 被过度激活时,导管细胞会不受控制地重新排列,从而破坏上皮结构,导致囊肿的形成。
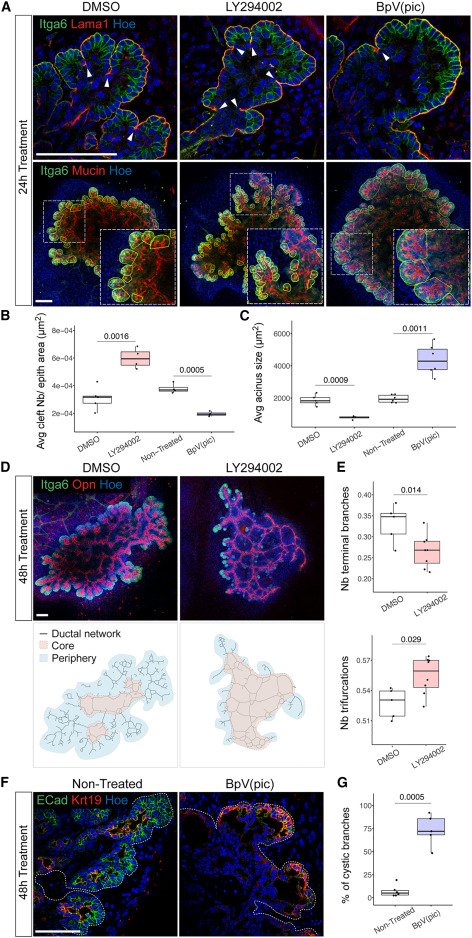
PI3K通路调控分支形态发生的细胞重排
总之,该研究为微调IGF/PI3K信号开辟了前景,微调IGF/PI3K信号可能有助于重建体内龛位,从而为促进人类胰腺器官组织的分枝提供起点。
参考文献:
Darrigrand JF, Salowka A, et. Acinar-ductal cell rearrangement drives branching morphogenesis of the murine pancreas in an IGF/PI3K-dependent manner. Dev Cell. 2024 Jan 13:S1534-5807(23)00691-3. doi: 10.1016/j.devcel.2023.12.011. Epub ahead of print. PMID: 38237591.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


