胶质母细胞瘤化学耐药的潜在机理取得进展
来源:生物探索 2023-11-02 17:10
该研究揭示了6-MP对GBM治疗的“一石二鸟”效应。重要的是,研究发现TMZ的代谢产物AICA是HPRT1的有效底物,并在TMZ处理下转化为AMPK激活剂AICAR以促进肿瘤细胞存活。
南京医科大学钱旭、尤永平及浙江大学吕志民共同通讯在Nature Communications发表题为“Hypoxanthine phosphoribosyl transferase 1 metabolizes temozolomide to activate AMPK for driving chemoresistance of glioblastomas”的研究论文,该研究证明了TMZ衍生的5-氨基咪唑-4-甲酰胺(AICA)在GBM细胞中转化为AICA核糖基-5-磷酸(AICAR)。这种转化由次黄嘌呤磷酸核糖转移酶1(HPRT1)催化,该酶在人GBM中高表达。替莫唑胺衍生的AICAR作为腺苷酸活化蛋白激酶(AMPK)的真正激活剂,激活AMPK磷酸化核糖核苷酸还原酶(RNR)的催化亚基RRM1的苏氨酸52 (T52),导致RNR活化和dntp生成增加,以促进替莫唑胺诱导的DNA损伤修复。
RRM1 T52A表达,HPRT1介导的AICAR产生的遗传中断,或6-巯基嘌呤(6-MP,一种临床批准的HPRT1抑制剂)的使用,可阻断TMZ诱导的AMPK激活,并使小鼠脑肿瘤细胞对TMZ治疗敏感。此外,在接受TMZ治疗的GBM患者中,HPRT1表达水平与不良预后呈正相关。总之,该研究揭示了TMZ在GBM治疗中导致化疗耐药的关键双功能作用。研究结果强调了联合应用临床可用的6-MP在克服TMZ化疗耐药和改善GBM治疗方面的潜力。

胶质母细胞瘤(GBM)是一种IV级胶质瘤,是成人中最常见的原发性恶性脑肿瘤类型,也是中枢神经系统最致命的癌症。替莫唑胺(TMZ)是唯一被证实可小幅改善GBM患者总生存期的化疗药物。标准疗程后的中位生存期仍仅为 12-15 个月。TMZ是一种小型亲脂性前药,经过自发水解成为活性代谢物单甲基三氮烯5-(3-甲基三氮-1-基)-咪唑-4-甲酰胺(MTIC)。MTIC进一步与水反应,释放出5-氨基咪唑-4-甲酰胺(AICA)和甲基重氮阳离子;后者将甲基递送到DNA的嘌呤碱基。甲基化嘌呤,尤其是O6-甲基鸟嘌呤,导致单链和双链DNA断裂和细胞周期停滞,最终导致肿瘤细胞死亡。
TMZ固有和获得性耐药是GBM治疗的主要临床挑战。TMZ化学耐药性主要归因于O-6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)介导的TMZ诱导的DNA甲基加合物的去除以及DNA损伤修复系统的激活。DNA损伤修复需要足够的脱氧核糖核苷三磷酸(dNTP),而dNTP生物合成从头途径的关键酶核糖核苷酸还原酶(RNR)介导核糖核苷二磷酸(NDPs)还原,从而产生脱氧核糖核苷二磷酸(dNDPs) 。
大量研究集中于TMZ衍生的甲基重氮阳离子的调控。然而,TMZ来源的AICA是否在TMZ化疗耐药中发挥作用尚不清楚。该研究证明了TMZ衍生的AICA通过HPRT1转化为AICAR。AICAR介导的AMPK活化磷酸化并激活RNR以产生用于TMZ诱导的DNA损伤修复的dNTP。HPRT1 耗竭或 6-MP 治疗使脑肿瘤对 TMZ 治疗敏感。
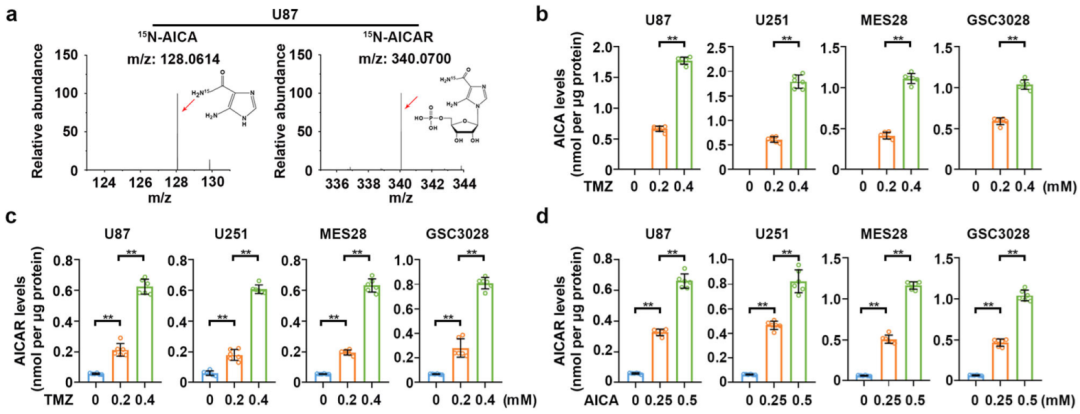
由AICA衍生而来的AICAR是TMZ真正的代谢产物(图源自Nature Communications )
因此,该研究揭示了6-MP对GBM治疗的“一石二鸟”效应。重要的是,研究发现TMZ的代谢产物AICA是HPRT1的有效底物,并在TMZ处理下转化为AMPK激活剂AICAR以促进肿瘤细胞存活。GBM标本中HPRT1的高表达及其与TMZ治疗的GBM患者预后的相关性,凸显了HPRT1介导的TMZ代谢和RNR激活在TMZ化疗耐药中的病理作用。6-MP和TMZ联合治疗在抑制脑肿瘤生长方面的协同作用强调了联合使用目前临床可用的药物6-MP克服TMZ耐药和改善GBM治疗的潜力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


