Science子刊:新研究揭示桩蛋白与FAK的相互作用可影响癌症的治疗抵抗性
来源:生物谷原创 2025-06-29 16:37
这项研究为一种难以表征的细胞蛋白网络增添了重要新细节。Salgia博士及其团队重点研究了桩蛋白,该蛋白可促使细胞根据环境变化进行调整。这有助于癌细胞进化并逃避检测,同时引发对治疗的抵抗性。
在一项新的研究中,由来自希望之城的科学家领衔的一个国际研究团队,对癌症治疗中一个难以捉摸的靶点进行了迄今为止最全面的阐述。他们指出一种涉及桩蛋白(paxillin)的复杂信号传导过程可能对治疗敏感,尽管该蛋白处于流动状态,其中桩蛋白是一种焦点粘附蛋白,作为连接其他蛋白的枢纽发挥作用。相关研究结果发表在Science Advances杂志上。

论文共同通讯作者、希望之城综合癌症中心医学肿瘤学教授Ravi Salgia博士说,“干扰桩蛋白与焦点粘附(focal adhesions)的相互作用对癌症治疗具有直接意义。这可导致靶向在癌细胞中占主导地位但在健康细胞中较为罕见的特定桩蛋白功能的精准治疗。”
这项研究为一种难以表征的细胞蛋白网络增添了重要新细节。Salgia博士及其团队重点研究了桩蛋白,该蛋白可促使细胞根据环境变化进行调整。这有助于癌细胞进化并逃避检测,同时引发对治疗的抵抗性。Salgia团队已致力于阐明桩蛋白的功能超过三十年。他和他的同事们于1995年在哈佛大学首次克隆了人类桩蛋白编码基因的全长序列。
为了更好地理解桩蛋白的作用,Salgia团队转向了其主要结合搭档,即焦点粘附蛋白激酶(focal adhesion kinase, FAK)。这一研究过程充满挑战。这两种蛋白共享大量用于结合的残基,且处于持续动态变化状态。桩蛋白本身也是一种高度无序的蛋白。
Salgia团队将他们的研究缩小至仅表征最相关的结构。最终,他们发现了一种与无序状态形成鲜明对比的稳定结构。当桩蛋白与FAK的C末端靶向结构域在特定停泊位点相互作用时,它们必须缩小尺寸并保持该状态以适应有限空间。然而,在与更广泛的焦点粘附网络相互作用时,它们仍保持高度灵活性。
“我们的研究结果揭示了一种在文献中鲜少被研究的蛋白相互作用新机制,并提示着此类机制可能适用于其他无序蛋白,”Salgia博士说道,“这项研究对一般的无序蛋白具有广泛的意义。”
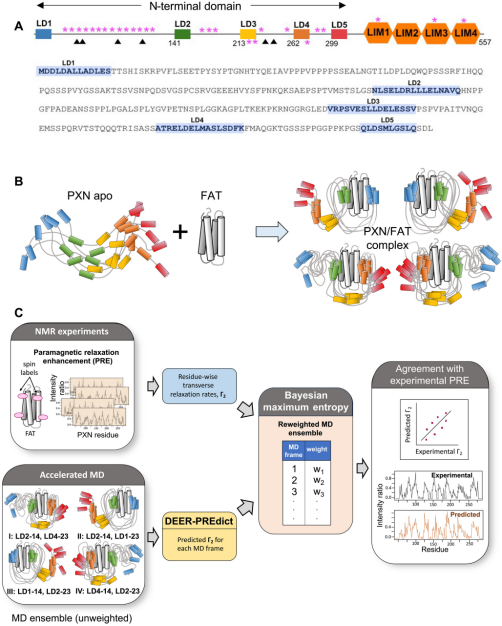
推导人类PXN与FAT结合的构象集合
此类蛋白相互作用通常被认为难以通过治疗手段控制,因为缺乏明确的药物靶向位点。但通过捕捉观察到的现象,Salgia团队构建了一个模型,这可能帮助其他研究人员识别动态靶点。
这一发现得益于大量巧妙的实验室研究工作。该团队利用一种与医学磁共振成像(MRI)相关的光谱学技术,更好地理解了桩蛋白的结构特征。随后,他们将光谱学与动态模拟相结合,展示了桩蛋白如何与FAK的C末端靶向结构域结合。最后,他们创建了一个计算机3D模型,以展示这种相互作用的具体过程。
论文共同通讯作者、希望之城计算与定量医学系助理研究教授Supriyo Bhattacharya博士说道,“所有这些方法的结合使我们能够比任何单一方法更准确地表征桩蛋白-FAK相互作用的结构特征。”(生物谷Bioon.com)
参考文献:
Supriyo Bhattacharya et al, Conformational dynamics and multimodal interaction of Paxillin with the focal adhesion targeting domain, Science Advances (2025). DOI: 10.1126/sciadv.adt9936.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


