JITC:豇豆花叶病毒竟然也可以作为抗癌疫苗!
来源:奇点糕 2023-01-03 10:37
这项研究证明了CPMV作为一种原位肿瘤疫苗,有效刺激系统性抗肿瘤免疫反应。当其与树突状细胞激动剂抗CD40抗体联用,可以激活抗原呈递细胞,并改善了肿瘤微环境
近年来,肿瘤疫苗逐渐成为重要的免疫疗法之一,而其中的原位疫苗(ISV)也有着越来越广泛的应用。ISV直接作用于肿瘤部位,发挥免疫刺激作用,招募免疫细胞至肿瘤部位,促进肿瘤抗原呈递,甚至可以引发全身性的抗肿瘤免疫反应[1]。
然而,由于免疫抑制性肿瘤微环境的存在,免疫效应细胞难以浸润,单独使用ISV的疗效并不理想,不足以根除肿瘤,也较少激发全身性的抗肿瘤免疫反应。如何将ISV与其他免疫疗法联合,引发局部和系统的抗肿瘤免疫反应,也是研究人员关注的热点问题。
近日,由达特茅斯学院的Steven Fiering领衔的研究团队。在《癌症免疫治疗》杂志发表重要研究成果[2]。
他们发现,将豇豆花叶病毒(CPMV)作为ISV治疗肿瘤,可以在部分肿瘤模型中引发T淋巴细胞及树突状细胞依赖性的抗肿瘤免疫反应。当CPMV与抗CD40抗体或抗PD-1抗体联合使用时,可以进一步诱导全身性抗肿瘤免疫反应,有效抑制肿瘤生长。
他们的研究证明,CPMV能够引发系统性抗肿瘤免疫反应,并且提供了一种新的联合治疗方式,即CPMV原位治疗+抗CD40抗体原位治疗+抗PD-1抗体。这种联合治疗方式有助于改善肿瘤微环境,加强抗原呈递,并克服肿瘤对于免疫检查点疗法的耐药性,诱导长效抗肿瘤作用。

论文首页截图
CPMV是一种植物病毒,无法感染动物细胞,但其衣壳及单链RNA可作为Toll样受体(TLR)激动剂[3-4],有效活化抗原呈递细胞,诱导细胞因子分泌,重塑肿瘤微环境。已有研究表明,CPMV可抑制小鼠肿瘤转移[5]以及犬类肿瘤生长[6]。
既然CPMV原位治疗能促进抗原呈递,引发抗肿瘤免疫反应,其激发系统性免疫反应的潜能如何呢?当其与免疫检查点疗法联合使用,能否针对不同癌症,实现强强联合的效果呢?
针对这些问题,研究人员展开了以下探索。
研究人员首先建立了不同的小鼠双侧肿瘤模型,包括小鼠黑色素瘤B16F10模型、结肠癌CT26和MC38模型,以及小鼠乳腺癌4T1肿瘤模型,并对荷瘤小鼠的一侧肿瘤给予两次CPMV原位治疗(瘤内注射)。在B16F10、CT26及MC38肿瘤模型中,双侧肿瘤生长均受到显著抑制,表明CPMV原位治疗带来了系统性的抗肿瘤免疫反应。而在免疫原性较差的4T1肿瘤中,双侧肿瘤生长均未受到抑制。
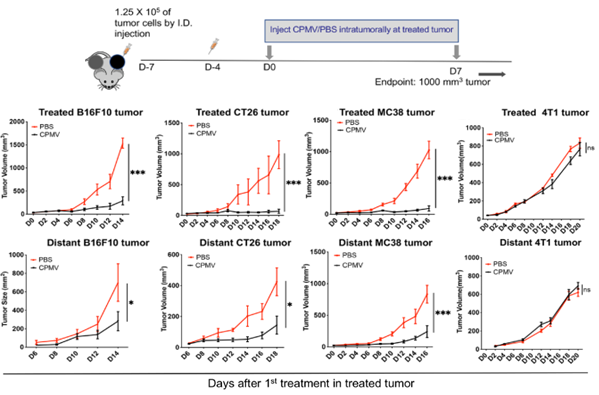
不同癌症对CPMV治疗响应各异
肿瘤疫苗作为免疫疗法的一种,其起效自然离不开免疫细胞的参与,接下来,研究人员探寻了CPMV原位治疗引发抗肿瘤免疫反应的机制。
研究人员发现,对于CPMV原位治疗有响应的B16F10荷瘤小鼠中,其肿瘤引流淋巴结内CD8+T淋巴细胞显著增多。而在缺乏T细胞和B细胞的Rag2-/-免疫缺陷小鼠中,CPMV原位治疗只能抑制治疗处的肿瘤生长,却无法抑制远端未治疗的肿瘤。当使用抗体去除荷瘤小鼠体内的CD8+T淋巴细胞,荷瘤小鼠也出现了类似的现象。
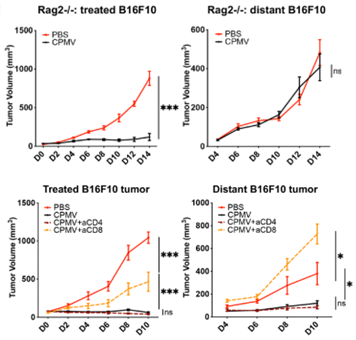
CPMV原位治疗带来的免疫反应部分依赖于CD8+T淋巴细胞
抗肿瘤免疫反应中,除了依赖于CD8+T淋巴细胞对肿瘤细胞进行攻击,抗原呈递细胞(APC)也是其中的重要一员。已经有研究表明,CPMV原位治疗的效果依赖于吞噬性的抗原呈递细胞[7],这类细胞起着处理和递送抗原的关键作用。因此,研究人员也观察了CPMV原位治疗后抗原呈递细胞的变化。
流式细胞术分析表明,CPMV原位治疗后,小鼠肿瘤内的树突状细胞(DC),尤其是cDC1细胞占比显著增多。而且,在树突状细胞缺陷小鼠(Batf3-/-小鼠)中,CPMV原位治疗只能延缓治疗处的肿瘤生长,对远端未治疗肿瘤则失去抑制作用。以上数据表明,cDC1细胞参与了CPMV原位治疗引发的系统性抗肿瘤免疫反应。
上述实验已经表明,树突状细胞在CPMV原位治疗引发的抗肿瘤免疫反应中发挥了重要的作用。于是,研究人员假设,使用激动剂进一步活化树突状细胞,是不是能进一步提高CPMV的治疗效果,引发更强的抗肿瘤免疫反应呢?
研究人员分别建立了黑色素瘤B16F10和乳腺癌4T1肿瘤模型,并分别对小鼠进行CPMV原位治疗、抗CD40抗体原位治疗或二者的联合治疗。结果表明,接受联合治疗的肿瘤显著减小,且远端未接受治疗的肿瘤生长也明显延缓。值得一提的是,免疫原性较差的4T1肿瘤也对这一联合疗法产生响应,再次证明了该联合疗法的潜力。
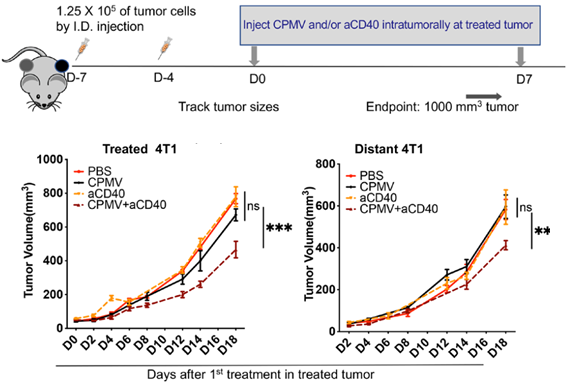
CPMV和抗CD40抗体联合原位治疗诱导了系统性抗肿瘤免疫反应
可以说,CPMV联合抗CD40抗体原位治疗有一定效果,但是4T1肿瘤仍持续生长。因此,研究人员在此的基础上引入了抗PD-1抗体,期待能更大程度抑制肿瘤生长。令人欣喜的是,对于乳腺癌4T1肿瘤,三重联合疗法对于双侧肿瘤都有着更强的抑制作用。

三重免疫疗法更加有效抑制了双侧4T1肿瘤生长
免疫检查点疗法在临床治疗中往往表现出一定的耐药性,研究人员也探索了CPMV和抗CD40抗体联合原位治疗是否有助于克服肿瘤对免疫检查点疗法的耐药性。
使用四次三重联合疗法后,双侧B16F10肿瘤几乎全部消失,小鼠生存期显著延长,而4T1乳腺癌荷瘤小鼠生存期也有所改善。可以说,CPMV和抗CD40抗体联合原位治疗帮助克服了免疫检查点疗法的耐药性,带来了更加持久的抗肿瘤免疫效果。
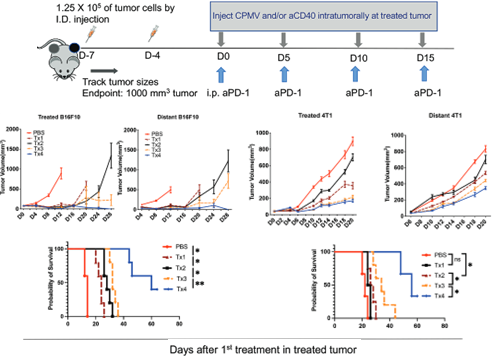
三重联合疗法有效延长荷瘤小鼠生存期
总的来说,这项研究证明了CPMV作为一种原位肿瘤疫苗,有效刺激系统性抗肿瘤免疫反应。当其与树突状细胞激动剂抗CD40抗体联用,可以激活抗原呈递细胞,并改善了肿瘤微环境,促进了“冷”肿瘤对于抗PD-1抗体的响应,该三重联合疗法为肿瘤治疗提供了一种新的思路。
CPMV原位治疗具有一定的优越性:其使用剂量较低,制作过程简便快速,因此带来了更低的成本;此外,使用CPMV原位治疗,不需要识别和合成肿瘤特异性新抗原,在治疗过程中,肿瘤本身及其所含的任何可识别抗原,都可以被当作免疫系统攻击的“靶标”,以带来更强的抗肿瘤免疫反应。如果该策略安全有效地转化至临床使用,将为更多肿瘤患者带去希望。
参考文献:
1. Mao C, Gorbet MJ, Singh A, Ranjan A, Fiering S. In situ vaccination with nanoparticles for cancer immunotherapy: understanding the immunology. Int J Hyperthermia. 2020;37(3):4-17. doi:10.1080/02656736.2020.1810333
2. Mao C, Beiss V, Ho GW, Fields J, Steinmetz NF, Fiering S. In situ vaccination with cowpea mosaic virus elicits systemic antitumor immunity and potentiates immune checkpoint blockade. J Immunother Cancer. 2022;10(12):e005834. doi:10.1136/jitc-2022-005834
3. Mao C, Beiss V, Fields J, Steinmetz NF, Fiering S. Cowpea mosaic virus stimulates antitumor immunity through recognition by multiple MYD88-dependent toll-like receptors. Biomaterials. 2021;275:120914. doi:10.1016/j.biomaterials.2021.120914
4. Albakri MM, Veliz FA, Fiering SN, Steinmetz NF, Sieg SF. Endosomal toll-like receptors play a key role in activation of primary human monocytes by cowpea mosaic virus. Immunology. 2020;159(2):183-192. doi:10.1111/imm.13135
5. Lizotte PH, Wen AM, Sheen MR, et al. In situ vaccination with cowpea mosaic virus nanoparticles suppresses metastatic cancer. Nat Nanotechnol. 2016;11(3):295-303. doi:10.1038/nnano.2015.292
6. Alonso-Miguel D, Valdivia G, Guerrera D, et al. Neoadjuvant in situ vaccination with cowpea mosaic virus as a novel therapy against canine inflammatory mammary cancer. J Immunother Cancer. 2022;10(3):e004044. doi:10.1136/jitc-2021-004044
7. Wang C, Fiering SN, Steinmetz NF. Cowpea Mosaic Virus Promotes Anti-Tumor Activity and Immune Memory in a Mouse Ovarian Tumor Model. Adv Ther (Weinh). 2019;2(5):1900003. doi:10.1002/adtp.201900003
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


