《自然·癌症》:在肺部沉睡多年的乳腺癌细胞为何会突然苏醒?科学家发现衰老相关的微环境是关键
来源:奇点糕 2023-04-18 10:02
他们发现,在年轻小鼠体内,DTCs低表达血小板源生长因子C(PDGF-C),有利于肿瘤细胞在原发灶以外部位存活,但不足以形成临床可见的转移灶;而在老年小鼠或纤维化的肺中
肿瘤转移是乳腺癌致死的最常见原因,在初次诊断后的10-32年期间,晚期乳腺癌复发率为15.53%,在第32年时累积复发率为16.6%[1]。
雌激素受体(ER)阳性的乳腺癌占总病例数的70%左右,这种病理分型的乳腺癌可谓十分狡猾,虽然治疗初期预后较好,但是在治疗数十年后,仍然有较大的转移复发风险[2, 3]。
这是因为有少数休眠的播散肿瘤细胞(DTCs)持续存在,它们最初悄无声息地潜伏在原发灶以外的部位,一旦被重新激活,便进入增殖状态,最终形成转移灶。所以,探究微环境如何调控DTCs的生存和激活,对于防治乳腺癌的远期复发具有重要意义。
近日,由英国癌症研究院Clare Isacke领衔的研究团队,在著名期刊《自然·癌症》上发表论文,阐述了年龄相关的微环境变化调控ER阳性乳腺癌转移性复发的机制[4]。
他们发现,在年轻小鼠体内,DTCs低表达血小板源生长因子C(PDGF-C),有利于肿瘤细胞在原发灶以外部位存活,但不足以形成临床可见的转移灶;而在老年小鼠或纤维化的肺中,环境中高水平的PDGF-C可促进DTCs增殖,并上调肿瘤细胞的Pdgfc水平,从而促进疾病进展。
本研究揭示了微环境中PDGF-C调节肿瘤进展的新机制,并且为预防ER阳性乳腺癌的转移性复发,提供了可能的治疗靶点。

论文截图
研究肿瘤远期复发的调控机制,并不是一件容易的事。
要想用动物模型研究肿瘤复发,意味着不仅要在动物体内实现DTCs长期存活、不被免疫系统清除,还要短时间内不能成瘤、没有临床表现,等于是放个定时炸弹,还要求它不能立马爆炸,这实在是种很难达成的微妙平衡。
Isacke团队利用ER阳性乳腺癌的同系小鼠模型,将小鼠来源的肿瘤细胞移植到遗传背景一致、免疫功能健全的小鼠体内,成功实现了肺部定植,却又不形成大转移灶。
Isacke和他的同事注意到,在体外培养条件下,ER阳性的小鼠乳腺癌细胞系增殖不活跃,用ER阴性的乳腺癌细胞或正常肺成纤维细胞上清处理后,才能重新开始增殖;原位移植模型也不像ER阴性的细胞能形成明显的转移灶,在肺部和其他器官仅有单个DTCs,或形成小于10个细胞的细胞团。
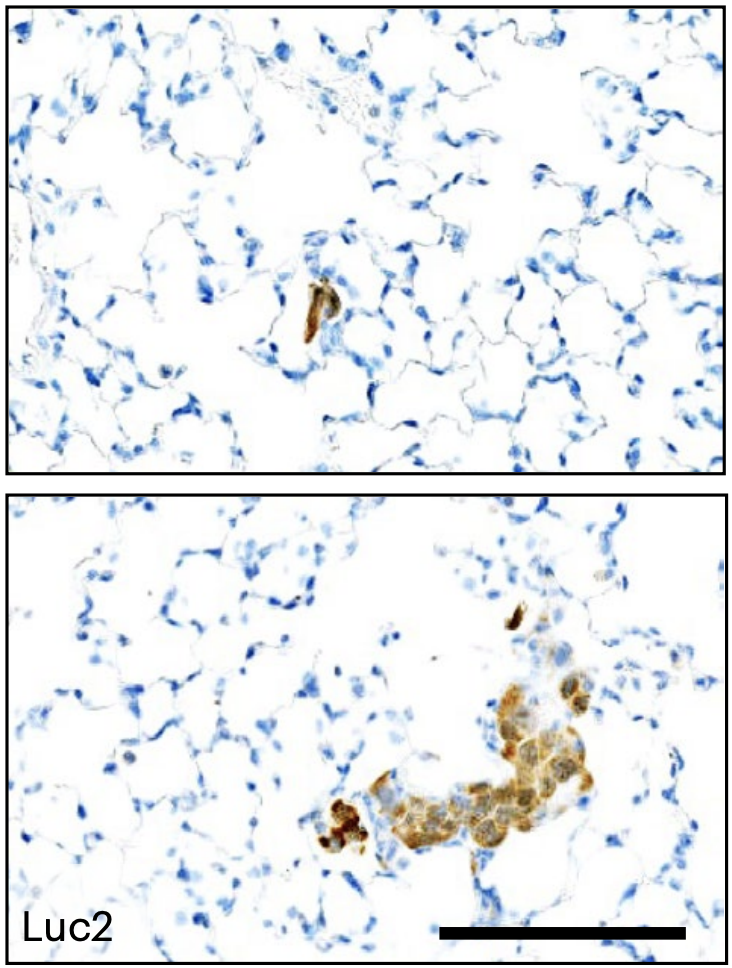
ER阳性乳腺癌原位移植模型,肺部未见宏观转移
考虑到ER阳性乳腺癌长期潜伏的特点,研究人员推测,既然肿瘤可能在几十年后才有转移性复发,会不会是衰老在其中起作用?
他们将年轻和年老小鼠模型进行了比较。在年轻小鼠体内,肺部的DTCs呈单个细胞或小细胞团形式,且只有极少数处于增殖状态;而在老年或纤维化的肺中,DTCs形成转移灶的能力更强。
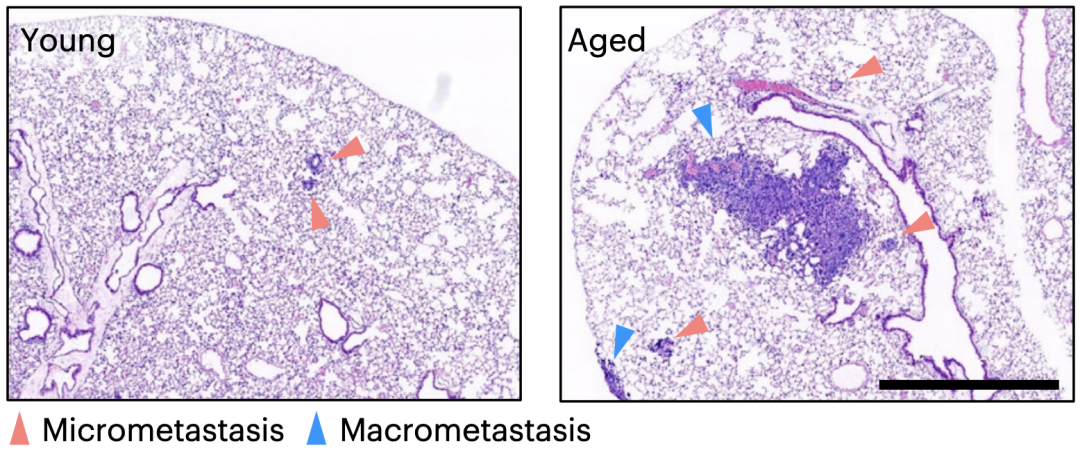
年轻(左)与年老(右)小鼠的肺部转移情况
接下来,研究人员对年轻和年老小鼠的肺组织进行了RNA-seq分析,发现成纤维细胞激活以及纤维化相关的基因存在差异表达。于是他们又进一步探究了肺纤维化在ER阳性乳腺癌转移性复发中的作用。
果不其然,在肺纤维化的小鼠模型中,ER阳性乳腺癌细胞形成转移灶的能力显著增强。结合先前肺成纤维细胞培养上清可刺激ER阳性乳腺癌增殖的结果,研究人员推测老年小鼠体内某些促纤维化因子加速了转移灶的形成。
经分析,Isacke团队发现促纤维化的生长因子——PDGF家族的多个基因在年老和年轻小鼠肺部的表达模式并不一致。具体来说,在老年小鼠中,经典的Pdgfa和Pdgfb低表达,而Pdgfc和Pdgfd表达较高;在肺纤维化的模型中,则只有PDGF-C蛋白表达显著升高。要知道,在不同年龄的人类肺组织中,PDGF-C也呈现出类似的表达模式。
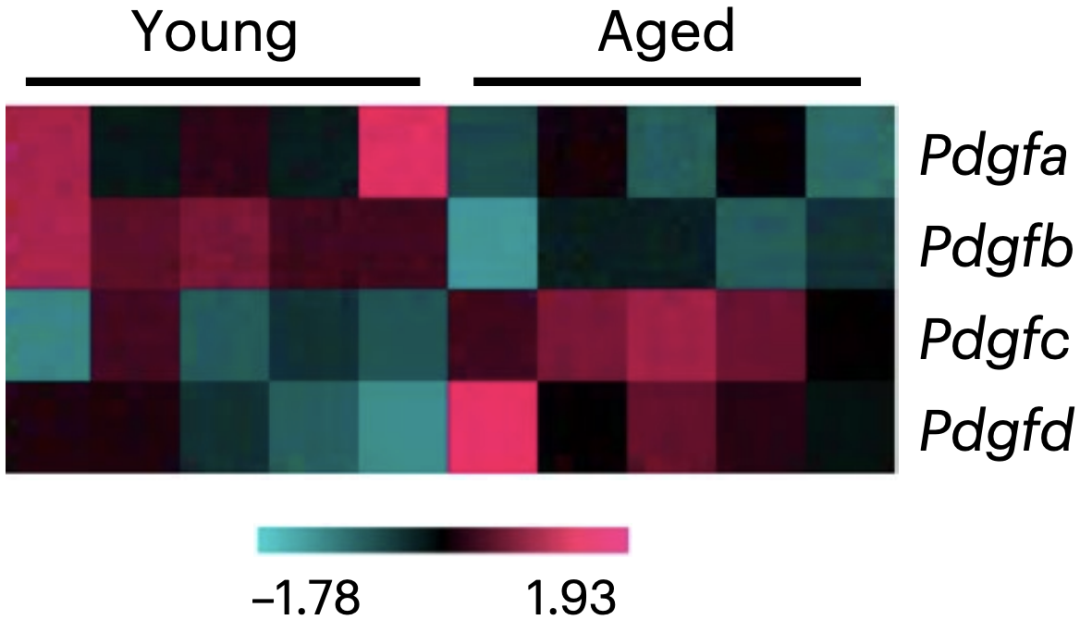
年轻(左)与老年(右)小鼠PDGF家族基因表达水平
除了在肺部具有年龄相关的表达差异之外,Pdgfc在肿瘤细胞中的表达水平也不是一成不变的。虽然体外培养的ER阳性乳腺癌细胞系Pdgfc表达水平很低,但从体内直接分离出的ER阳性乳腺癌细胞却高表达Pdgfc。并且,在老年小鼠肿瘤模型的肺部转移灶中,Pdgfc表达水平也比年轻小鼠肺部的DTCs更高。
无论是从微环境还是从肿瘤自身来看,PDGF-C都可能与ER阳性乳腺癌转移性复发脱不了干系!
那么PGDF-C究竟对肿瘤和微环境分别有什么影响呢?原来,肿瘤细胞自身的Pdgfc表达主要促进DTCs在肺部形成更多散在的小细胞团,对原发灶和转移部位的肿瘤体积影响不大。换言之,只能让肿瘤散若满天“星”,却聚不成一团“火”。光想靠肿瘤自身实现复发,也没那么容易。
其实,动物体内表达PDGF-C受体的主力是成纤维细胞,它们才是复发过程中PDGF-C的主要目标。研究人员发现,PDGF-C可以促进成纤维细胞增殖与迁移,并且有助于成纤维细胞激活、向病灶处聚集。当肺组织向着纤维化的方向发展,DTCs增殖和肿瘤复发不过就是顺水推舟的事了。
到这里,PDGF-C“助纣为虐”的角色基本确定了,但同时它也可能成为有效阻断转移性复发的靶点。Isacke团队发现,PDGF受体抑制剂伊马替尼可抑制肿瘤相关成纤维细胞(CAF)的活性,并且使转移灶的体积与数量均减少。
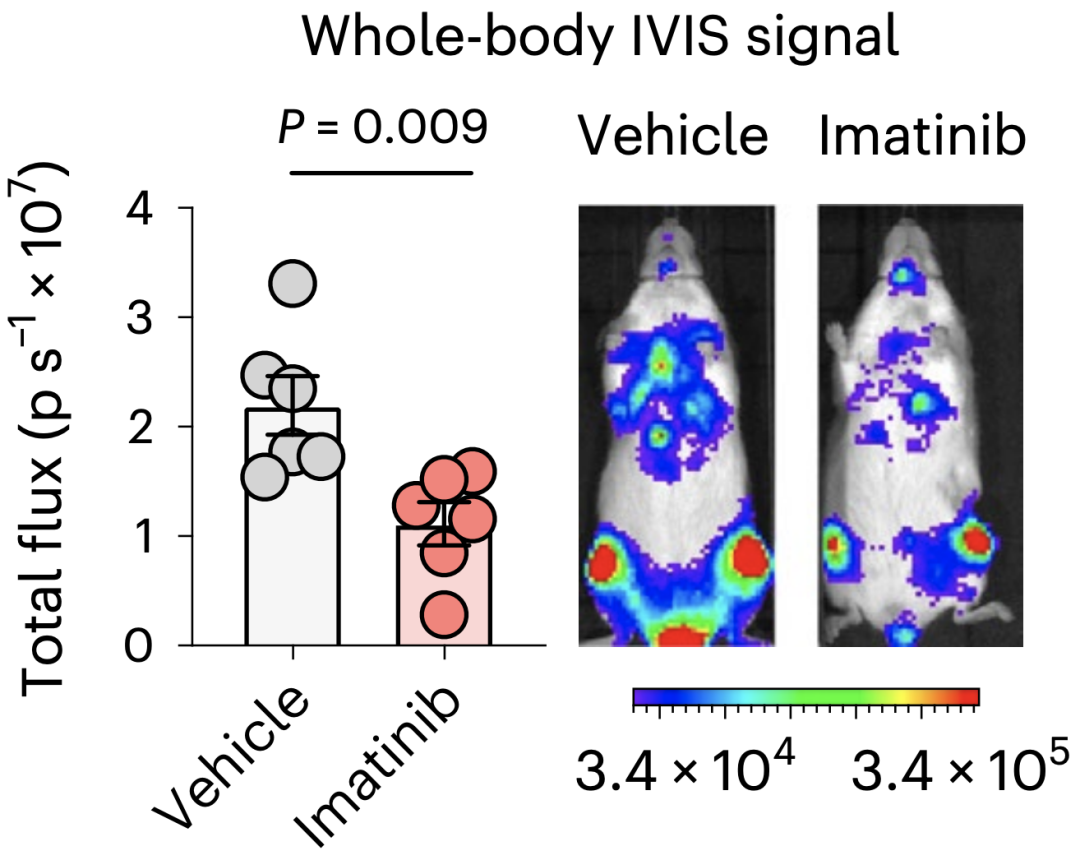
伊马替尼可缩小转移病灶
肿瘤复发对于患者及其家庭而言,无疑是一记沉重的打击。本研究不仅提出了ER阳性乳腺癌转移性复发的新机制,也进一步确认了年龄带来的复发风险。未来,靶向PDGF-C的药物若能成功应用于临床,或许将有助于减缓ER阳性乳腺癌的肺部进展,造福更多患者。
参考文献:
[1] Pedersen RN, Esen BÖ, Mellemkjær L, et al. The Incidence of Breast Cancer Recurrence 10-32 Years After Primary Diagnosis. J Natl Cancer Inst. 2022;114(3):391-399. doi:10.1093/jnci/djab202
[2] Ribelles N, Perez-Villa L, Jerez JM, et al. Pattern of recurrence of early breast cancer is different according to intrinsic subtype and proliferation index. Breast Cancer Res. 2013;15(5):R98. doi:10.1186/bcr3559
[3] Pan H, Gray R, Braybrooke J, et al. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med. 2017;377(19):1836-1846. doi:10.1056/NEJMoa1701830
[4] Turrell FK, Orha R, Guppy NJ, et al. Age-associated microenvironmental changes highlight the role of PDGF-C in ER+ breast cancer metastatic relapse. Nat Cancer. 2023;10.1038/s43018-023-00525-y. doi:10.1038/s43018-023-00525-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


