华中农业大学研究者们揭示了来自约氏乳杆菌的细胞外囊泡可以促进肠道屏障稳态
来源:生物谷原创 2024-04-09 10:20
本研究结果揭示了益生菌调节巨噬细胞极化以增强肠道屏障功能的分子机制。
腹泻病是长期困扰人类和动物的全球性健康问题。腹泻的病因复杂,包括细菌和病毒感染、药物不良反应、肠道炎症和免疫缺陷。尽管科学界在过去数十年间对腹泻病机制的研究取得了显著进展,揭示出腹泻常伴随肠道微生物群落失衡与肠道屏障功能障碍,但至今该病症仍导致高发病率与死亡率,迫切需要研发更为安全有效的防治策略。
近年来,通过补充益生菌有针对性地改变肠道微生物群已成为治疗肠道疾病的一种有希望的选择。来源于健康个体的益生菌已被广泛证明除了维持肠道上皮屏障外,还能改善肠道菌群结构和调节免疫力。
细菌分泌的细胞外囊泡(EVs)对宿主的影响是通过效应分子的运输和递送介导的。来自益生菌的ev有利于调节宿主免疫、肠道屏障完整性,并提供其他有益效果。例如,研究发现嗜黏蛋白阿克曼菌分泌的EVs通过多重途径调节肠道稳态,减轻结肠炎。虽然分子机制尚未完全揭示,但益生菌衍生的EVs有望成为对抗肠道炎症和腹泻疾病的新策略。

图片来源:https://doi.org/10.1016/j.jare.2024.03.011
近日,来自华中农业大学动物科技学院的研究者们在J Adv Res杂志上发表了题为“Extracellular vesicles derived from Lactobacillus johnsonii promote gut barrier homeostasis by enhancing M2 macrophage polarization”的文章,该研究表明来自约氏乳杆菌的细胞外囊泡通过增强M2巨噬细胞极化来促进肠道屏障稳态。本研究旨在探讨益生菌精准调控巨噬细胞以应对腹泻病的分子机制。
研究者利用宏基因组揭示了健康和腹泻仔猪的肠道微生物组谱,并采用粪便微生物移植(FMT)技术探讨了肠道微生物与腹泻的因果关系。
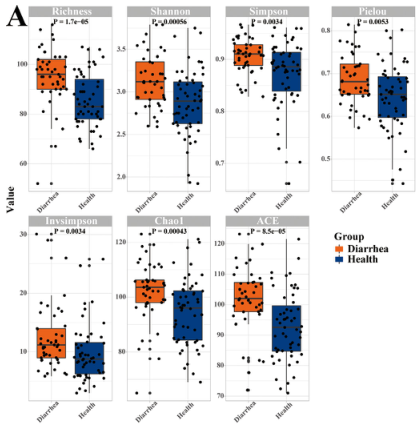
腹泻和健康仔猪肠道微生物组特征
图片来源:https://doi.org/10.1016/j.jare.2024.03.011
研究结果表明:大肠杆菌在断奶腹泻仔猪中富集,而约氏乳杆菌与大肠杆菌呈负相关。利用粪便微生物移植(FMT)实验,研究者证实腹泻疾病症状的传播是通过将粪便微生物群(而不是代谢物)从腹泻猪转移到无菌(GF)小鼠来实现的。约氏乳杆菌的干预阻止了腹泻仔猪疾病表型向GF小鼠的传播,并且减轻了ETEC K88引起的肠道炎症。
更深入的分析表明,约氏乳杆菌分泌的EVs通过调节巨噬细胞表型来减轻ETEC K88诱导的不良影响。体外实验表明,ev通过关闭ERK的方式激活M2巨噬细胞,从而抑制肠上皮细胞中NLRP3的激活。
也就是说,该研究结果表明,肠道微生物失衡是腹泻病发生的驱动力,而益生菌衍生的EVs通过调节巨噬细胞表型,有效地改善腹泻症状。这一发现为开发基于益生菌EVs的创新腹泻疾病治疗方法提供了有力支持。
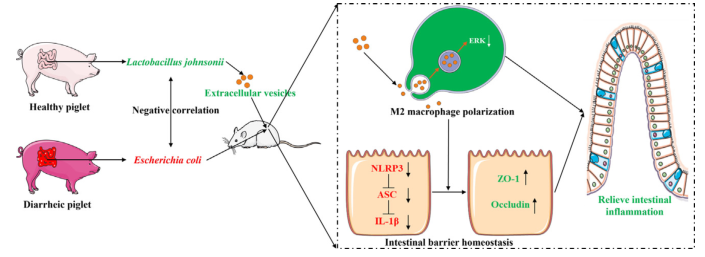
来自约氏乳杆菌的细胞外囊泡通过增强M2巨噬细胞极化来促进肠道屏障稳态
图片来源:https://doi.org/10.1016/j.jare.2024.03.011
综上所述,本研究发现腹泻仔猪肠道微生物群失调,大肠杆菌和约氏乳杆菌分别是与腹泻疾病密切相关的潜在病原菌与有益菌。腹泻病症状的关键生理和免疫学特征可以在GF小鼠中通过肠道微生物群而不是代谢物再现。
此外,从健康个体分离的约氏乳杆菌通过抑制炎症反应,可以显著减轻腹泻症状,其衍生的EVs则表现出强大的抗腹泻能力,并且ev对巨噬细胞表型的调节是缓解腹泻疾病所必需的。机制上,约氏乳杆菌衍生的EVs通过抑制ERK表达,促进巨噬细胞向M2抗炎表型的转化,进而阻断肠上皮细胞的NLRP3信号通路,修复屏障功能。
总之,本研究结果揭示了益生菌调节巨噬细胞极化以增强肠道屏障功能的分子机制。这些发现为未来设计针对益生菌EVs和巨噬细胞极化调控的新型腹泻疾病治疗策略提供了理论依据。尽管当前研究仍面临特定益生菌菌株疗效的筛选与动物模型成果向临床转化的挑战,但无疑为腹泻疾病的精准防治开辟了崭新视角。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


