Science:颠覆传统基因组结构变异研究,Genome-Shuffle-seq的高效生成与精确检测
来源:生物探索 2025-02-05 14:57
这项技术通过集成一类名为“Shuffle cassette”的基因组构件,将多个SV诱导事件以高通量的方式集成到细胞群体中,并能利用特定的条形码系统,在不同的细胞内追踪这些变异的发生与影响。
在基因组学的研究中,结构变异(Structural Variants, SVs)一直是一个备受关注却又充满挑战的领域。与常见的单核苷酸变异(Single Nucleotide Variants, SNVs)和小型插入缺失变异(indels)相比,SVs的研究面临着诸多难题。SVs指的是基因组中大于50个碱基对的变异,包括缺失、重复、倒位、易位等形式,这些变异往往能够显著影响基因功能、基因表达及细胞的整体健康。然而,SVs的研究在以往主要依赖于一些较为有限的方法,这些方法通常效率低下且成本高昂。
为了克服这一挑战,1月31日Science的研究报道“Multiplex generation and single-cell analysis of structural variants in mammalian genomes”,研究人员开发了Genome-Shuffle-seq这一创新性技术,旨在通过一种简便且高效的方式,在哺乳动物基因组中进行大规模的SV生成、标记和检测。这一方法的最大亮点在于其能在单个实验中同时生成并精确追踪成千上万种SV,且无需依赖于传统的克隆筛选、基因分型或全基因组测序技术。这项技术通过集成一类名为“Shuffle cassette”的基因组构件,将多个SV诱导事件以高通量的方式集成到细胞群体中,并能利用特定的条形码系统,在不同的细胞内追踪这些变异的发生与影响。
该方法特别适用于在体外胚胎干细胞等细胞模型中进行SV的研究,并且能够对这些结构变异在细胞转录组中的表现进行精准的映射和分析。这项技术不仅能够帮助研究人员更好地理解SV对基因表达、染色质结构及基因组三维架构的影响,还能为后续癌症研究等领域提供强有力的支持。特别是在肿瘤学中,许多癌症的发生与结构变异密切相关,Genome-Shuffle-seq的应用有望加速我们对这些变异的深入理解,并为精准治疗提供新的思路。
通过这项技术,研究人员能够在单细胞分辨率下追踪变异与基因表达的关系,甚至能够在基因组中精确地定位这些变异的起源及其在细胞中的动态变化。这不仅为我们提供了一个全新的视角,也为结构变异的功能性研究开辟了崭新的道路。

结构变异:基因组中的“隐形杀手”
在我们的基因组中,除了单核苷酸变异(SNVs)和插入缺失(indels)这两种常见的变异类型,还有一类变异同样具有深远的生物学影响,那就是结构变异(SVs)。它们不像点突变那样易于识别,但其对基因组功能的影响却远比我们想象的要复杂和深远。
相比于SNVs和indels,SVs往往涉及更大范围的基因组重排,可能会影响到多个基因及其调控区域。以往的基因组研究大多集中于研究单个碱基的变异,如SNVs,它们与疾病的关系早已得到了大量的证实。然而,结构变异由于其较低的发生频率和复杂的遗传模式,长期以来在功能性研究中被忽视。研究表明,SVs在许多复杂疾病,尤其是癌症中扮演着至关重要的角色。例如,肿瘤的发生往往伴随着基因组的广泛重排,这些重排可能导致肿瘤抑制基因的丧失或癌基因的激活,从而推动肿瘤的发展和转移。
克服传统方法的局限:Genome-Shuffle-seq
传统的SV检测方法,诸如全基因组测序(WGS)、染色体微阵列(CMA)以及荧光原位杂交(FISH)等,往往依赖于高成本和高复杂度的技术,且在精确定位和高通量筛选方面存在局限。尤其是对于大规模结构变异的生成和检测,这些方法往往需要长时间的实验设计和复杂的后期分析,且很难在单一实验中同时生成和精确捕捉成千上万种SV。
除此之外,由于SV的低频率和变异范围的巨大差异,现有技术在覆盖广泛变异类型方面常常存在盲区。例如,CRISPR/Cas9技术虽然能高效引发定点的基因编辑,但它的效能在大规模结构变异生成上却受限于效率和精度问题。此外,传统的技术往往依赖于单细胞克隆或逐个基因组样本分析,这使得研究人员只能获得有限的SV数据,缺乏足够的变异样本来进行全面的功能分析。
针对这些局限,Genome-Shuffle-seq技术的出现无疑为结构变异的研究提供了强有力的支持。这项创新技术的核心在于通过引入“Shuffle cassette”(洗牌盒)构件,利用Cre-loxP重组机制在基因组中高效地生成各种类型的SV,包括缺失、倒位、易位等。与传统方法不同,Genome-Shuffle-seq技术能够在单个实验中同时诱导并精准追踪多种SV事件,且无需依赖繁琐且昂贵的全基因组测序。研究人员通过这项技术,能够在不进行克隆筛选的情况下,通过条形码标记对每个SV事件进行高效的识别和分类。
此外,Genome-Shuffle-seq的独特之处还在于其能够以单细胞分辨率捕捉结构变异的动态变化。通过单细胞RNA测序(scRNA-seq)与T7原位转录技术结合,研究人员能够在每个细胞水平上追踪不同结构变异与基因表达之间的关系,这为深入理解SVs对基因功能和细胞命运的影响提供了全新的视角。
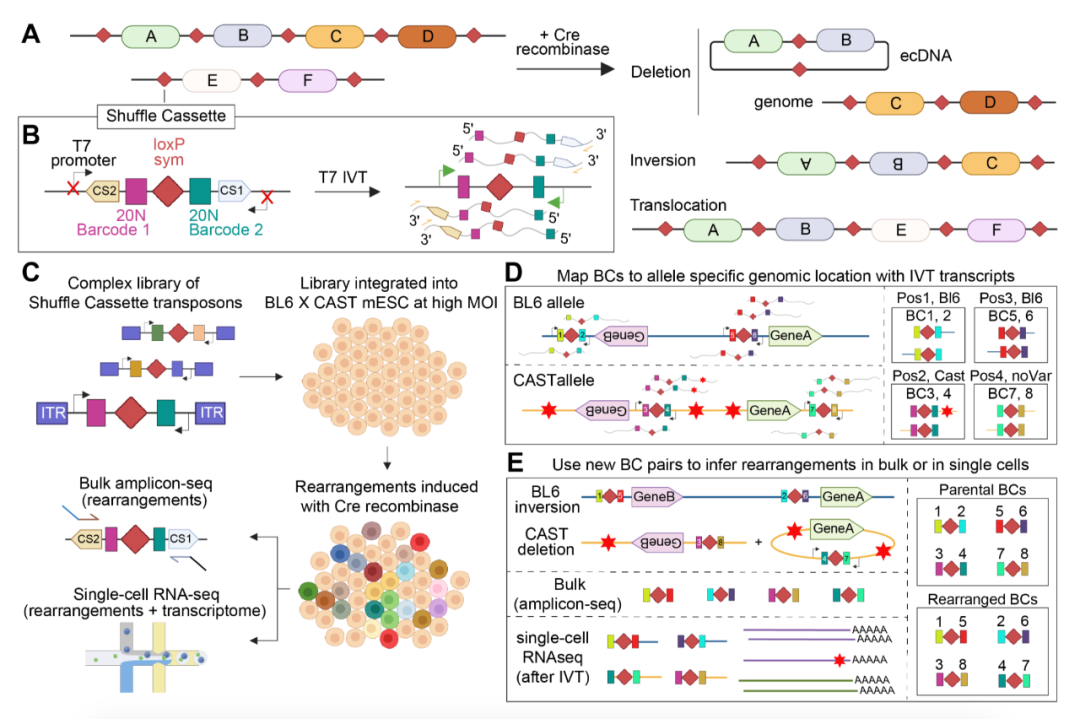
Genome-Shuffle-seq技术的整体框架和操作流程(Credit: Science)
A:在基因组中集成的loxPsym位点阵列如何在Cre重组酶的作用下,发生重组并生成三类主要的结构变异(SVs),包括缺失、倒位和易位。这些变异通过Cre介导的重组事件生成,从而在基因组中引入多种结构变异。
B:Shuffle cassette的结构,这是一种用于生成SV的构件。每个shuffle cassette包含一个loxPsym位点,两侧分别有独特的20个核苷酸条形码、用于捕获scRNA-seq数据的序列(CS1、CS2),以及在活细胞中不活跃但在体外转录(IVT)或原位转录(IST)时能被激活的噬菌体RNA聚合酶启动子。这些条形码和捕获序列能够精确标记每个变异事件,并为后续的基因组定位提供必要信息。
C:Genome-Shuffle-seq实验的工作流程。通过这种方法,shuffle cassette可以被随机或有针对性地整合到基因组中,并在细胞群体中引发结构变异。随后,通过IVT或IST技术获得转录数据,对这些变异进行定位和表征。
D:通过T7原位转录或体外转录序列来映射shuffle cassette的插入位置。每个插入点都通过唯一的条形码对进行标记,并与基因组中的特定位点关联。通过这些条形码,可以准确定位每个变异的发生位置。
E:通过条形码的组合,推断诱导的结构变异类型(如缺失、倒位、易位)。当Cre重组酶在细胞中介导变异时,新的条形码组合出现在这些变异的子集细胞中,通过与已知的父代条形码坐标结合,研究人员可以确定变异类型及其基因组定位。
Shuffle Cassette:基因组中的“卡片”重组
在Genome-Shuffle-seq技术中,“Shuffle cassette”作为核心构件,扮演着至关重要的角色。它不仅是生成结构变异(SVs)的工具,还通过其独特的设计和重组机制,实现在基因组中高效、精准地引入各种类型的变异,包括缺失、倒位和易位等。
Shuffle cassette本质上是一段包含多个功能模块的DNA序列,其中最关键的部分是loxPsym位点,这是一种可以被Cre重组酶识别并催化重组的特殊序列。通过将这类“洗牌盒”随机插入到基因组中,每个插入位点都带有独特的标记条形码。当Cre重组酶作用于这些位点时,它可以在同一细胞内驱动两个shuffle cassette之间的重组,生成不同类型的结构变异。具体而言,当两个盒子之间发生重组时,可能导致基因组的缺失(当两片段融合在一起)、倒位(片段方向颠倒)或易位(片段移到其他染色体上)等结构性改变。
这一过程的优势在于,重组事件是精确可控的,通过调整Cre酶的表达,可以在不同时间点诱导SVs的形成,这使得研究人员能够系统地生成大量不同类型的SV,而不需要借助传统的随机突变方法或耗时的细胞筛选。
更为独特的是,每个shuffle cassette的两侧都有两个20nt条形码(barcode),这使得每个插入位点都可以被独特标记。当这些条形码与基因组中的特定位置结合时,形成一个能够被精确追踪的标记系统。这些条形码不仅可以帮助标定SV事件的发生,还能通过高通量测序对每个变异的发生位置和频率进行分析。特别是在大规模的细胞群体中,条形码技术可以帮助研究人员快速识别和追踪不同类型的SV,这对于理解这些变异在细胞中的传播及其对基因功能的影响至关重要。
高通量和单细胞解析:探索SV与基因表达的联系
为了理解变异如何影响细胞的行为,尤其是它们如何在单细胞层面上与基因表达相互作用,Genome-Shuffle-seq技术通过与单细胞RNA测序(scRNA-seq)结合,为研究人员提供了前所未有的高通量分析能力。
利用Shuffle cassette系统,研究人员能够在细胞群体中生成不同类型的结构变异,并通过条形码技术精确地追踪每个变异的位置。通过单细胞分离与RNA测序(scRNA-seq)结合,研究人员可以在每个单独细胞内检测其基因表达谱,并与对应的结构变异信息进行比对。这种结合不仅能够揭示每个细胞内的基因表达特征,还能帮助研究人员理解这些变异如何在细胞内引发功能性的变化。
在该研究中,研究人员采用了T7原位转录技术(IST)与scRNA-seq相结合的策略,使得每个细胞内的结构变异条形码可以与其转录组数据一同捕捉。通过这一方法,研究人员能够将每个细胞内的结构变异信息与其基因表达谱精确地关联起来,从而描绘出结构变异如何具体影响基因表达。在小鼠胚胎干细胞中,研究人员成功地对带有不同结构变异的细胞进行了单细胞RNA测序,发现那些带有特定SVs的细胞在基因表达上存在显著差异,尤其是在涉及细胞增殖、分化等重要生物学过程的基因上。
通过这种高通量和单细胞层面的分析,研究人员能够深入探讨结构变异对细胞功能的具体影响。特别是在癌症等复杂疾病的研究中,结构变异常常会导致基因的表达失调,这可能是肿瘤细胞增殖和转移的关键驱动因素。通过将结构变异与单细胞基因表达数据相结合,研究人员不仅能够揭示SVs如何影响单个细胞的行为,还能够理解这些变异在整个细胞群体中的动态演变。
通过这种独特的结合方式,Genome-Shuffle-seq技术为结构变异的功能性研究提供了一个全新的视角。研究人员可以在单细胞分辨率下,精确追踪结构变异对基因表达的影响,并探索这些变异在细胞功能、基因调控及疾病机制中的作用。
从小鼠胚胎干细胞到肿瘤研究:技术的应用与前景
Genome-Shuffle-seq技术的强大之处不仅在于其对结构变异(SVs)的大规模生成和检测,还在于它在不同研究领域中的广泛应用,尤其是在小鼠胚胎干细胞(mESCs)和癌症研究中的潜力。通过这项技术,研究人员可以在一个实验中精确生成并追踪成千上万种SV,从而深入分析它们对基因功能和细胞行为的具体影响。
在小鼠胚胎干细胞的研究中,研究人员能够在不依赖克隆筛选或全基因组测序的情况下,在小鼠胚胎干细胞中生成大量的结构变异,并通过条形码技术追踪每个变异的发生及其基因组位置。数据表明,研究人员成功地在小鼠胚胎干细胞中生成并标记了超过9,000种SV,这些变异的精确定位为后续的功能性研究奠定了基础。
更重要的是,Genome-Shuffle-seq技术与单细胞RNA测序(scRNA-seq)的结合,使得研究人员能够在单细胞水平上分析这些结构变异对基因表达的影响。在小鼠胚胎干细胞实验中,研究人员不仅揭示了不同结构变异对基因表达的具体影响,还发现这些变异在细胞群体中的动态变化。这为未来对细胞功能和发育过程的研究提供了宝贵的见解,特别是关于SV如何调控细胞分化、增殖及命运的变化。
这项技术在癌症研究中的潜力也尤为突出。在肿瘤细胞中,结构变异往往是导致基因功能失调、肿瘤发生和进展的关键因素。通过Genome-Shuffle-seq,研究人员能够在肿瘤模型中高效诱导并精确分析与肿瘤相关的结构变异。例如,研究人员通过应用这一技术,成功识别了与肿瘤发生密切相关的SVs,并揭示了这些变异如何通过影响基因表达及染色质结构,从而推动肿瘤的形成和转移。这一过程不仅揭示了结构变异与癌症发展的密切联系,也为精准医学提供了新的理论依据。
此外,Genome-Shuffle-seq技术还能够为癌症相关SVs的高通量筛选和功能分析提供有力支持。通过在肿瘤模型中应用这一技术,研究人员可以在不依赖昂贵的全基因组测序的情况下,快速识别出大量的肿瘤相关SV,并进一步研究这些变异如何影响肿瘤细胞的基因表达谱。随着这项技术的不断优化,未来或许能够通过大规模的结构变异数据分析,为癌症的早期诊断、个性化治疗以及精准靶向药物开发提供强大的工具。
结构变异的未来研究方向
Genome-Shuffle-seq技术的问世为结构变异(SVs)的研究带来了前所未有的突破。实验数据展示了不同类型SV的频率和分布特征。在小鼠胚胎干细胞中,缺失和倒位事件显著多于易位,且这些变异大多发生在基因组的内含子和基因间区域。这一发现强调了结构变异对基因功能的潜在影响,尤其是在基因调控和表达的层面。尽管如此,易位事件在所有检测的SV中占据了较大的比例,表明其在基因组中的产生具有更高的组合性,但由于易位的独特性质,较少的重复发生导致其在数据中的出现频率低于缺失和倒位。总体来看,研究揭示了SVs在基因组中的广泛分布,且不同变异类型在各个染色体上的分布具有一定的相关性。
然而,尽管Genome-Shuffle-seq技术在SV生成和检测方面取得了显著进展,仍然存在一系列挑战需要解决。首先,研究表明,结构变异在诱导后往往会在细胞群体中迅速消失,这可能与Cre重组酶的毒性作用以及SV本身对细胞生存的负面影响相关。特别是在小鼠胚胎干细胞中,经过Cre重组后,部分细胞在经历了重排事件后表现出较差的生长和生存能力,导致变异细胞群体的减少。尽管通过使用p53抑制剂Pifithrin-α在一定程度上缓解了这一问题,但仍难以完全解决SV的快速消失和细胞存活问题。
其次,克隆扩增仍然是结构变异研究中的一大难题。尽管Genome-Shuffle-seq能够高效生成大量的SV,但由于SV在细胞群体中的快速稀释和变异率较低,单细胞层面的变异扩增仍面临困难。当前,依赖于单细胞克隆和基因组扩增的过程较为繁琐且效率较低,限制了对变异的深入解析。
未来,随着技术的不断优化,预计这些挑战将得到一定程度的解决。改进Cre重组酶的表达调控或使用更温和的替代酶可能有效减轻Cre毒性,进而提高SV的稳定性和细胞存活率。此外,基因组扩增技术的进步在大规模SV研究中的应用,可能进一步提高克隆扩增效率,为研究人员提供更多的SV样本用于分析。另一方面,随着单细胞测序技术的进一步发展,未来或许能够实现更加精准的SV定量和基因表达分析,使得每个细胞内的结构变异与基因表达的关系更加清晰。
总的来说,Genome-Shuffle-seq为结构变异的研究提供了一个强大的工具,虽然目前仍面临一些技术性挑战,但随着技术的不断突破,我们有理由相信,未来结构变异的研究将能够更深入地揭示其在基因功能、细胞行为以及疾病发展中的作用。这将为精准医学、癌症治疗等领域的突破性进展提供坚实的基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


