我国首款mRNA疫苗印尼获批,近岸蛋白为您细述疫苗那些事
来源:近岸蛋白 2022-10-20 15:40
mRNA疗法正在被传染病、肿瘤、罕见病、自身免疫性疾病等领域企业积极布局,正在重塑生物医学格局。
2022年9月30日,印度尼西亚国家食品药品监管局局长佩妮·卢吉托宣布,由中国人民解放军军事科学院军事医学研究院、艾博生物与沃森生物共同研发的新冠mRNA疫苗ARCoV获得由印度尼西亚国家食品药品监管局授予的紧急使用授权,用于18周岁及以上人群通过主动免疫来预防新冠肺炎。

新华社孙磊摄
ARCoV自此成为全球第三款上市的mRNA疫苗,印尼即将实现本地化生产的第一款mRNA疫苗。ARCoV的成功,一定程度上,标志了我国mRNA疫苗技术已打破欧美技术垄断。
mRNA疫苗技术是什么?有多重要?近岸蛋白在这里为您细细道来。
疫苗发展史
总结疫苗发展历史发现,疫苗研究经历了3个重要阶段:
第一次疫苗革命发生于19世纪末20世纪初,主要通过生物传代或物理化学方法处理病原体得到减毒或灭活疫苗。此外,这一时期还出现了类毒素疫苗。
20世纪80年代,以酵母制备的乙肝疫苗的问世标志着第二次疫苗革命的到来。主要有基因工程亚单位疫苗、具备双重免疫作用的基因工程载体疫苗、替换或剔除毒素基因的基因缺失活疫苗,还有多肽疫苗。
20世纪90年代,以核酸DNA或者RNA作为疫苗直接注射到肌肉中,通过在肌细胞内表达,产生相应抗原,并诱导宿主细胞产生免疫应答的mRNA疫苗标志着第三次疫苗革命的到来。1987年,Robert Malone将mRNA与脂滴混合,然后与人细胞系孵育,发现这些细胞可以表达mRNA所编码的蛋白。随后经历数百位研究人员30余年的努力,在2019年底爆发的全球新冠大流行中,诞生了已在全世界接种数十亿剂的新冠mRNA疫苗。
mRNA疫苗优势
mRNA疫苗的生产不像传统疫苗生产技术需要培养细胞或病毒,而是依靠体外合成技术,如图1所示,从mRNA的体外转录到mRNA-LNP复合物的制备,mRNA疫苗的整个生产周期可能仅需要10天。在病毒变异时,mRNA疫苗也可以通过改变基因序列迅速应对。
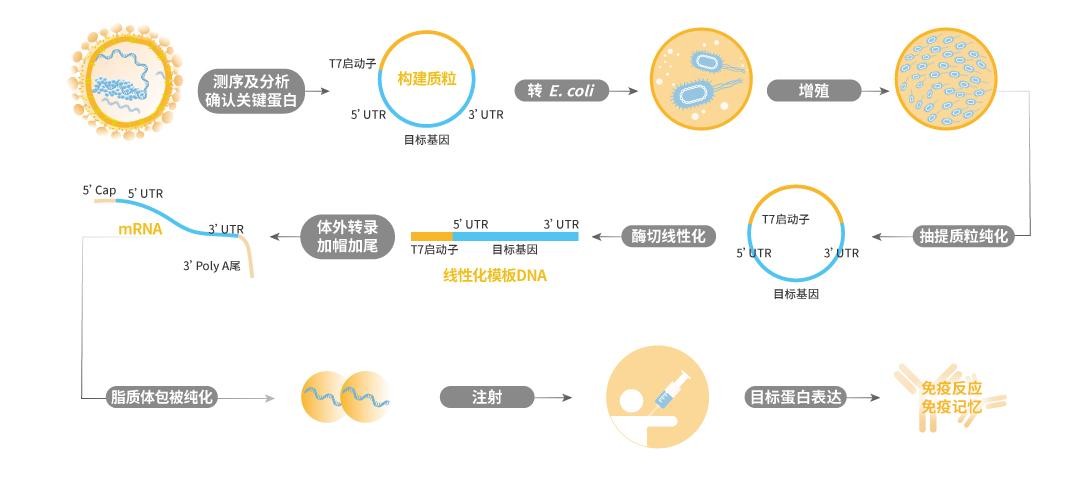
mRNA疫苗的生产过程
相较于传统疫苗,mRNA 疫苗的优势在于研发速度快、制备步骤简单、平台化、易扩充产能,同时可用于精准化和个性化治疗。与DNA疫苗相比,其起效快,没有整合宿主基因组的风险,会在体内自动降解,安全性更高。
在防控新冠肺炎的战役中,Moderna和BioNTech的两款mRNA疫苗充分印证了该技术的强大优势。临床结果显示,BioNTech的BNT162b2作为两剂方案的疫苗有效性为94%,同时,其加强针可以增对Omicron变体的中和作用。Moderna开发的mRNA-1273临床三期结果显示,疫苗保护率达到94.1%。对α和β变异的有效性分别为100%和96.4%,对Delta的有效性略低(73.1%)。其加强针提供了针对Delta变异株的高且持久的保护(95.2%),但对Omicron的保护较低(62.5%)。总体而言,尽管疫苗对SARS-CoV-2的有效性随着时间的推移而降低,但接种BNT162b2和mRNA-1273仍然有效预防其他变体的感染,减少重症和死亡率。
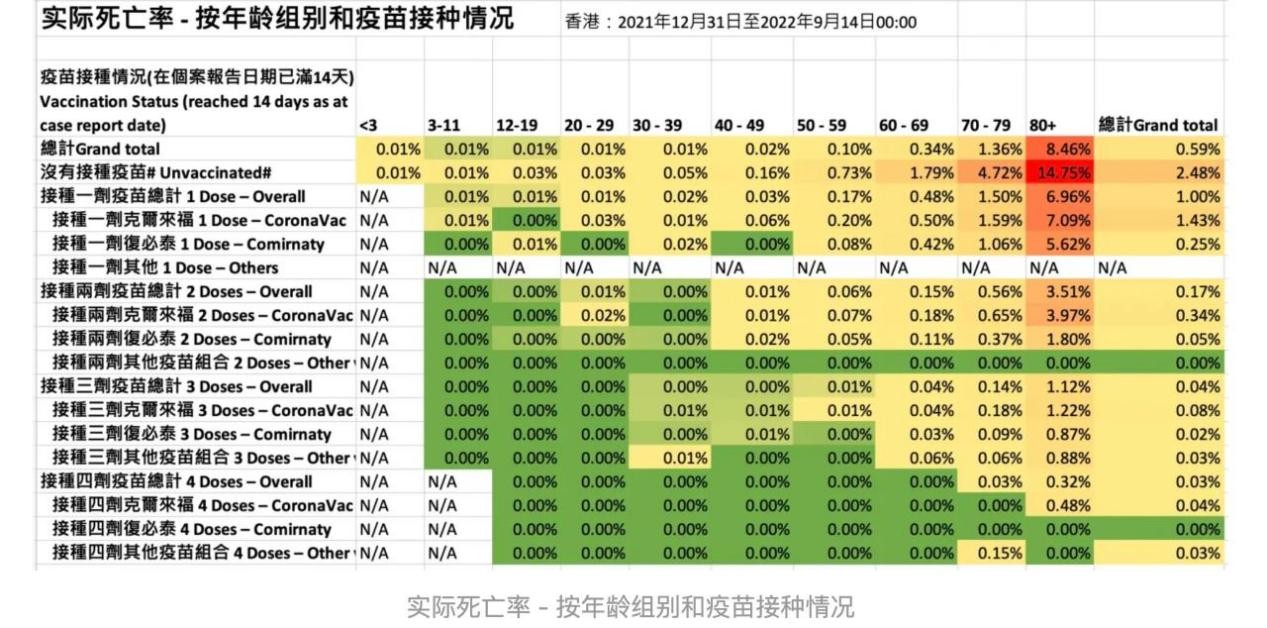
数据来源香港政府官网
近岸蛋白mRNA原料及CRO解决方案
苏州近岸蛋白质科技股份有限公司(简称:近岸蛋白)在mRNA原料领域布局多年, 为多家国内肿瘤疫苗研发企业一起推进mRNA在肿瘤疫苗中的应用,并在2020年成为国内传染病mRNA疫苗的主要原料酶供应商。 据统计,全球已接种数十亿剂新冠mRNA疫苗,这对整条产业链都造成了巨大冲击。面对爆发式增长的原料需求,近岸蛋白布局建设了GMP级原料酶生产基地。基地设计规模达到年产50亿人份mRNA疫苗原料酶,首期建设已完成2条2000L规模发酵、纯化和制剂的规模化生产线,部分品种单批次生产规模达千克级。在规划设计过程中,考虑到成本、长远供应及采购挤兑等问题,近岸蛋白在产能方面做了3至5倍的冗余,确保未来10年内原料的持续输出。产能之外,供应链问题的另一个维度是质量。mRNA疫苗属于一个全新的生产与质量控制体系,近岸蛋白在原料生产之初便把质控提高到药用级别,建立了严格的质量管理体系,并通过ISO9001、14001、45001等质量管理体系认证,形成上千页的技术文件、检测和管理文件,与原料一并移交给客户,以节约客户在原料放行等检测方法上的研发成本,更好地集中精力做核心研发。
在全球mRNA疫苗药物开发黄金时期,国产mRNA疫苗要出海,必将面临各地区的政策法规要求。面对这一问题,近岸蛋白率先考虑到酶原料需要做出相应准备,于2021年将全套酶产品做了美国FDA DMF备案,使药物申报者可以直接使用DMF备案编号来代替申报过程中需要提供有关原料的具体信息,节约审批成本,提高审批效率。同时,面对部分有穆斯林人口需求的地区,mRNA疫苗生产商需要保证其产品所有物料溯源达到清真要求,据悉,近岸蛋白于2022年将其mRNA原料生产基地菏泽工厂进行了HALA清真认证,免除mRNA疫苗生产商的后顾之忧。
除原料供应方面,近岸蛋白同时还在开发mRNA原液制备及检测工艺,以期为客户提供更全面的服务。
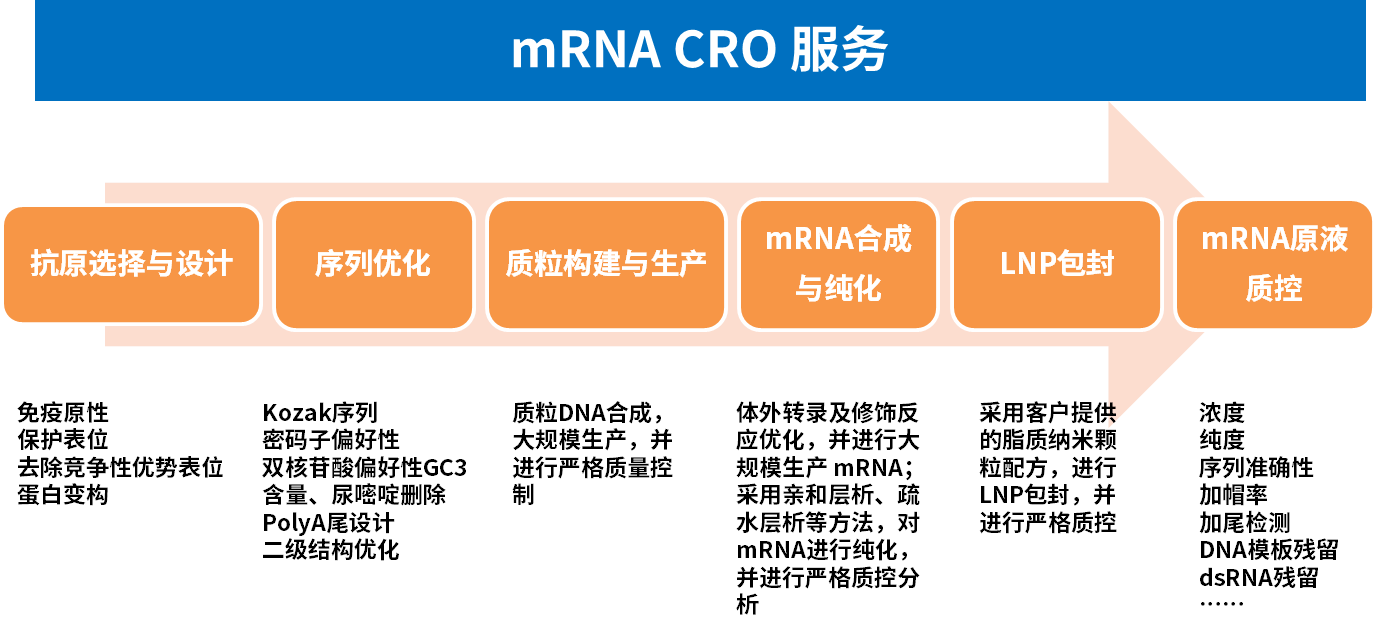
mRNA疫苗生产可分为mRNA原液生产以及mRNA疫苗制剂生产两大块。mRNA原液生产首先是设计并生产质粒DNA,并将其线性化,然后通过T7 RNA聚合酶的作用,将线性DNA体外转录为RNA,进一步通过加帽酶、mRNA Cap 2'-O-甲基转移酶等将RNA加以修饰,最后通过纯化和超滤浓缩形成mRNA原液。制剂生产主要是利用脂质体对mRNA原液进行包封,随后进行成品灌装及质量控制,形成最终的产品。依托自身mRNA原料酶优势,近岸蛋白建立从质粒生产到mRNA原液生产的全流程CRO服务。除此之外,根据国家药监局药审中心发布的《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)》,和美国药典(USP)制定指南草案《mRNA疫苗质量分析方法》,近岸蛋白建立并优化了mRNA原液质量控制体系,以检测关键质量属性、以及与过程相关的残留物和安全性。
由于mRNA的治疗方法在其通用性、适应性、成本方面具有关键优势,mRNA疗法正在被传染病、肿瘤、罕见病、自身免疫性疾病等领域企业积极布局,正在重塑生物医学格局。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


