结节性痒疹创新药!Dupixent(度伐利尤单抗)获美国FDA优先审查:显著减轻瘙痒和皮损!
来源:生物谷原创 2022-05-31 20:19
Dupixent是第一种在结节性痒疹3期临床试验中显示阳性结果的药物,证实了靶向IL-4和IL-13(2型炎症的关键和中心驱动因素)治疗瘙痒和皮损的潜在益处。

2022年05月31日讯 /生物谷BIOON/ --赛诺菲(Sanofi)与合作伙伴再生元(Regeneron)近日宣布,美国食品和药物管理局(FDA)已受理抗炎药Dupixent(达必妥,通用名:dupilumab,度普利尤单抗)的补充生物制品许可申请(sBLA)并授予了优先审查:用于治疗结节性痒疹(prurigo nodularis)成人患者。根据《处方药申报者付费法案》(PDUFA),FDA做出决议的目标日期为2022年9月30日。
结节性痒疹是一种会引起极度瘙痒和炎症性皮肤病变(结节)的慢性2型炎症性皮肤病。不受控的结节性痒疹对生活质量的影响是炎症性皮肤病中最严重的一种,伴有强烈的慢性瘙痒。目前,结节性痒疹尚无批准的系统治疗方法。临床上常用高效价局部类固醇,但如果长期使用,会带来安全风险。
Dupixent是第一种在结节性痒疹3期临床试验中显示阳性结果的药物,证实了靶向IL-4和IL-13(2型炎症的关键和中心驱动因素)治疗瘙痒和皮损的潜在益处。
此次sBLA基于2项关键3期临床试验(PRIME2,PRIME)的数据支持。这2项试验在18岁及以上结节性痒疹患者中评估了Dupixent的疗效和安全性。2项试验均达到了主要终点和关键次要终点,数据显示:与安慰剂相比,Dupixent治疗显著改善了疾病症状和体征,包括减少了瘙痒和皮肤病变。
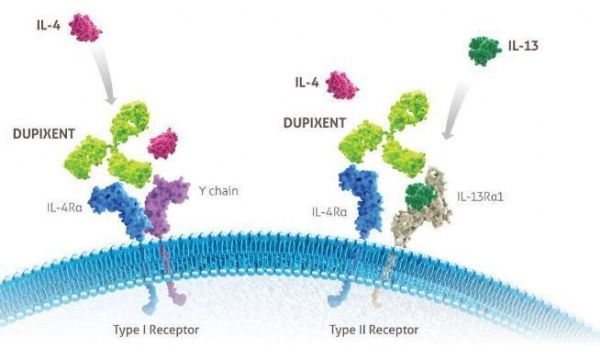
Dupixent作用机制(图片来源:dupixenthcp.com)
PRIME2和PRIME采用了相似的试验设计,均为随机、双盲、安慰剂对照3期试验,分别在160名和151名结节性痒疹成人患者中评估了Dupixent的疗效和安全性,这些患者的疾病接受局部处方疗法治疗未得到充分控制,或这些治疗不可取。在24周治疗期间,患者每2周接受一次Dupixent(n=78)或安慰剂(n=82),并进行或不进行局部治疗(低剂量或中剂量局部皮质类固醇或局部钙调神经磷酸酶抑制剂,如果患者在随机化时使用这些治疗,则继续使用)。
主要终点评估了在第12周时(PRIME2研究)和第24周时(PRIME研究)瘙痒有临床意义改善的患者比例(通过最差瘙痒数字评分量表[WI-NRS]降低≥4分(0-10)。关键次要终点包括第24周瘙痒有临床意义改善的患者比例(PRIME2研究)和第24周皮损完全清除或几乎完全清洁的患者比例(PRIME2研究和PRIME研究,通过研究者整体评估PN期[IGA PN-s]0-4量表评分为0或1测量)。2项研究的其他次要终点包括与健康相关的生活质量(根据0-30分皮肤病生活质量指数相对基线的变化测量)、皮肤疼痛(根据0-10分量表相对基线的变化测量)以及焦虑和抑郁症状(根据0-42分医院焦虑和抑郁量表评分相对基线的变化测量)。
PRIME2研究:主要结果显示,在治疗第12周,Dupixent治疗组有37%、安慰剂组有22%的患者瘙痒程度较基线检查时有临床意义的减轻(p=0.0216)。关键次要终点结果显示:(1)在治疗第24周,Dupixent治疗组瘙痒较基线有临床意义减轻的患者比例是安慰剂组的3倍(58% vs 20%,p<0.0001);(2)在治疗第24周,Dupixent治疗组皮损达到完全清除或几乎完全清除的患者比例是安慰剂组的3倍(45% vs 16%,p<0.0001)。
PRIME研究:主要终点结果显示:在治疗第24周,瘙痒程度较基线检查时有临床意义减轻的患者比例,Dupixent治疗组是安慰剂组的3倍多(60% vs 18%;p<0.0001)。关键次要终点结果显示:在治疗第24周,Dupixent治疗组皮损达到完全清除或几乎完全清除的患者比例是安慰剂组的近3倍(48% vs 18%,p=0.0004)。
2项研究中,Dupixent治疗组在健康相关生活质量、皮肤疼痛、焦虑和抑郁症状方面均有显著改善。这些试验中的安全性结果通常与Dupixent在其已批准的皮肤病适应症中的已知安全性特征一致。Dupixent治疗最常见的不良反应是结膜炎。
Dupixent靶向2型炎症的关键驱动因素,该药是一种全人源化单克隆抗体,特异性抑制2种关键蛋白IL-4和IL-13的过度激活信号。IL-4/IL-13是2种炎症因子,据认为是过敏疾病和其他2型炎症疾病中内在炎症的关键驱动因素。
Dupixent于2017年3月底上市,已获批治疗4种由2型炎症导致的疾病:嗜酸性食管炎(EoE,≥12岁患者)、中度至重度特应性皮炎(≥6岁患者)、中度至重度哮喘(≥6岁患者)、伴鼻息肉的慢性鼻-鼻窦炎(CRSwNP,成人患者)。
在中国,Dupixent(达必妥)分别于2020年6月、2021年9月、2022年2月获得国家药品监督管理局(NMPA)批准,现在是中国唯一获批可用于治疗儿童(≥6岁)、青少年、成人中重度特应性皮炎(AD)的靶向生物制剂。
除目前批准的适应症外,赛诺菲和再生元正在评估Dupixent治疗由2型炎症或其他过敏引起的广泛疾病,包括:儿童特应性皮炎(6个月至5岁,3期)、手足特应性皮炎(3期)、有2型炎症证据的慢性阻塞性肺病(3期)、结节性痒疹(3期)、慢性自发性荨麻疹(3期)、病因不明的慢性瘙痒(3期)、慢性诱导性感冒性荨麻疹(3期)、无鼻息肉的慢性鼻窦炎(3期)、过敏性真菌性鼻窦炎(3期)、过敏性支气管肺曲霉菌病(3期)。(生物谷Bioon.com)
原文出处:FDA Accepts Dupixent® (dupilumab) for Priority Review in Adults with Prurigo Nodularis
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


