厦大团队再获突破,基于二甲双胍发明纳米药物,可加速Aβ清除改善小鼠认知
来源:奇点糕 2022-05-05 09:33
近些年痴呆确诊患者数量庞大也是事实。我们熟悉的阿尔茨海默病(AD),俗称老年性痴呆,就是其中一种,AD患者表现为记忆减退、思维混乱、认知障碍及性格行为改变等,极大地影响了自身和家庭的日常生活,也对全球
近些年痴呆确诊患者数量庞大也是事实。我们熟悉的阿尔茨海默病(AD),俗称老年性痴呆,就是其中一种,AD患者表现为记忆减退、思维混乱、认知障碍及性格行为改变等,极大地影响了自身和家庭的日常生活,也对全球健康事业的发展提出了严峻的挑战。因此,痴呆不可不知,也不可不防。
近日,厦门大学的杨立朝研究员带领团队,设计开发了一种按需释放的双药(多奈哌齐+二甲双胍)超分子纳米递送系统,用于协同治疗AD。
他们发现,这种结构稳定的包涵体复合物不仅可以选择性透过血脑屏障(BBB),延长药物在脑中的蓄积时间,还能提高小胶质细胞对淀粉样蛋白β(Aβ)的清除效率,表现出显著的抗痴呆作用[1]。

论文首页
AD是一种神经退行性脑部疾病,尽管其发病机制尚未完全阐明,但科学家们发现,AD患者大脑中通常呈现出细胞内神经纤维缠结和细胞外Aβ沉积的特征[2],而Aβ的产生与清除之间失衡是驱动AD的因素之一[3]。因此,促进Aβ清除是AD治疗领域内一个极具前景的研究方向。
小胶质细胞就相当于大脑中的巨噬细胞,同样履行的是“大扫除”的职责。利用小分子药物促进小胶质细胞对Aβ的清除是改善AD主要选择之一,但是小分子药物的应用面临着诸多挑战,如非特异性分布、靶向性差、清除迅速以及毒性作用严重等[4]。
相反,具有合适粒径的纳米药物(< 120nm)能够有效通过BBB将小分子药物递送至大脑,提高治疗效率。此外,智能响应性双药纳米系统的开发,不仅解决了传统纳米药物剂量要求高、毒副作用大以及容易耐药等问题,而且在病灶部位按需释放的优势有效避免了药物在血液循环过程中的泄露[5-7]。
多奈哌齐(Don)是一种美国食品药物监管局(FDA)批准的乙酰胆碱酯酶(AchE)抑制剂,通常用于改善AD患者病症[8]。但由于Don疏水性较强,通过Don与磷脂(PC)之间的超分子识别作用自组装而成的Don-PC包涵体复合物,容易出现严重的药物泄露和生理不稳定性等问题。
二甲双胍(Met)原本是治疗2型糖尿病的临床一线药物,随着研究深入,科学家们发现二甲双胍能显著改善AD相关的神经病理学变化,例如Aβ异常沉积、Tau磷酸化和记忆缺陷[9],另外,Met的胍基还能明显增强纳米药物的结构稳定性。
基于此,杨立朝研究员团队利用主客体分子间的相互作用,制备了一种Aβ响应性的双药包涵体复合物(MPD),其不仅具有优越的生物稳定性和靶向释放性,还能通过增加Aβ的清除率以及抑制AchE活性而发挥协同抗痴呆作用。
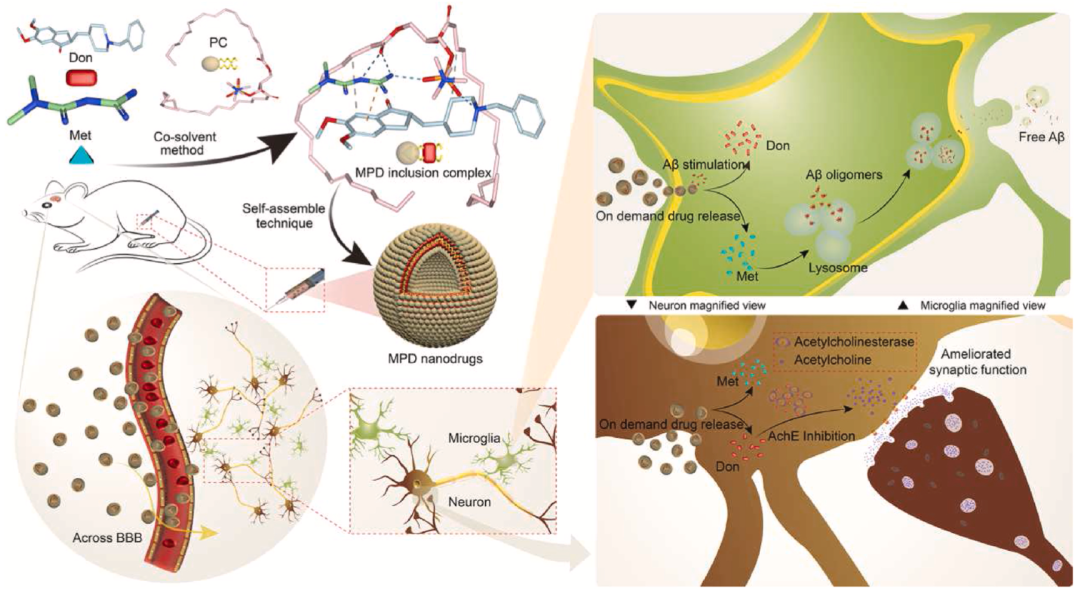
Aβ响应性包涵体复合物的制备及其协同抗痴呆治疗效果示意图
经多次摸索,研究员们通过薄膜分散法成功制备了MPD包涵体,并利用分子对接(AutoDock Vina程序)、1H-核磁共振(1H-NMR)和傅里叶变换红外光谱(FT-IR)等多种技术,对MPD包涵体的形成机理进行了探究。
结果表明,Met的胍基可通过氢键和盐桥与PC的磷酸基团相互作用,而Don的芳香基团可通过π-π堆叠与PC的长链脂肪酸相互作用,形成MPD包涵体复合物的结构。
此外,研究员们还通过X射线衍射(XRD)和透射电子显微镜(TEM)揭示了Met与Don的分布状态。他们发现,Met和Don以晶体形式均匀分布在PC基质中,在非极性溶剂中,PC的极性头向内朝向Met,PC向内的非极性尾部朝向Don,向外的非极性尾部朝向有机相,以产生球形纳米结构。
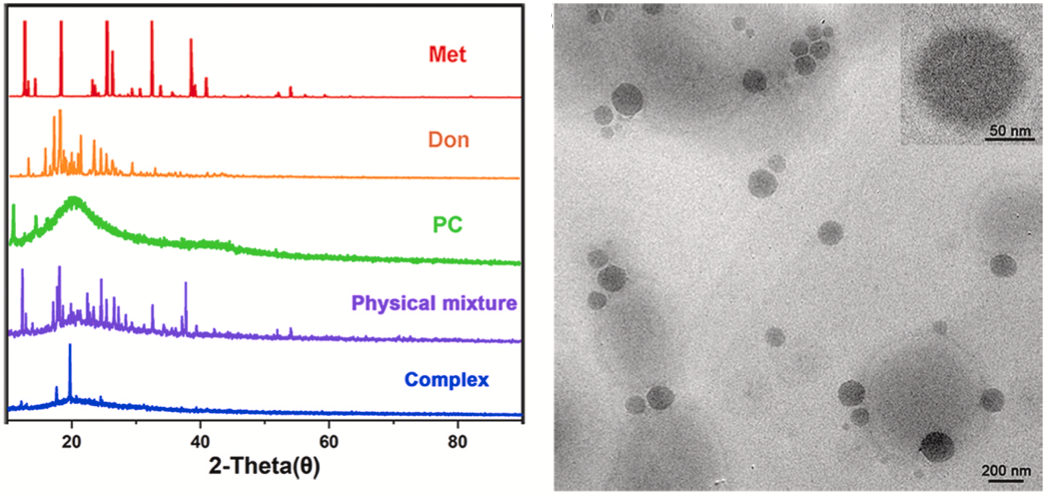
MPD包涵体的XRD和TME表征
为进一步优化制剂工艺以获得理想的MPD,杨立朝研究员团队表征了三种不同配比的MPD包涵体的形貌、流体动力直径、分散性、ζ电位以及药物封装效率。经对比筛选,他们最终将Met : Don : PC的重量比确定为1 : 1 : 4,此时,MPD粒径约110nm,ζ电位约-21.3mV,有利于穿透BBB且具有良好的胶体稳定性和单分散性。Met和Don的载药率分别为13.7%和12.1%,包封率分别为82.3%和72.5%。
之后,研究员们验证了MPD包涵体解组装及Aβ响应性按需释放的性能。他们分别用不含或含Aβ (30 U/mL) 的PBS模拟正常人体和AD患者的生理环境,结果显示,与含Aβ的PBS孵育后,MPD形态不再均一规则,粒径也有增加的迹象,表明MPD能够响应Aβ而出现部分解组装和聚集现象。
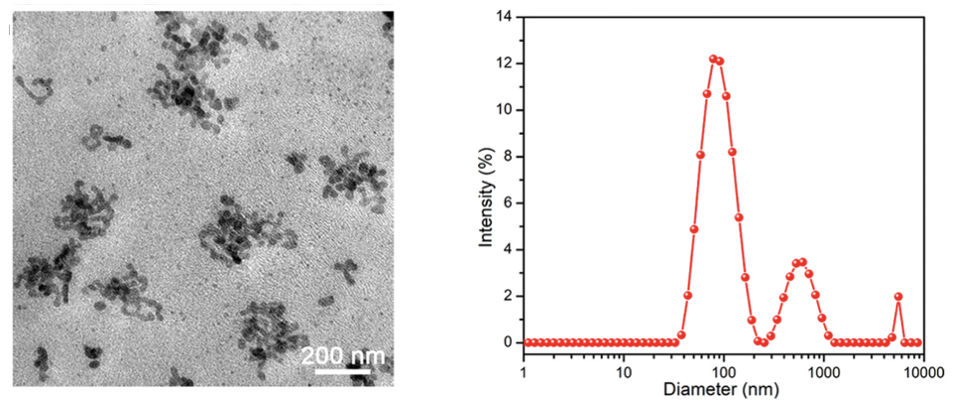
与含Aβ的PBS孵育后MPD包涵体的TME图像及流体动力直径
此外,PBS组的释放曲线显示,在72小时内,从MPD中释放出来的Met和Don分别不到32%和37%,这间接表明MPD具有出色的生理稳定性。相反,在含Aβ的PBS孵育72小时,MPD中Met与Don的累积释放分别大于83%和82%,呈现出响应性释放的特征。
上述研究结果证实,MPD响应性按需释放的优势有望在富含Aβ的大脑区域实现Met和Don的同步释放,提高协同治疗效率,并减少对正常细胞和组织的不良作用。
接下来,研究员们对MPD的靶向性及穿透血脑屏障的能力做了验证。
体内验证渗透血脑屏障的设计方法如下图所示,利用单层bEnd.3细胞在上、N2a和BV2细胞在下的结构来模拟血脑屏障结构,并以荧光基团标记MPD来获得具有荧光特性的内涵体复合物(MNPD)以便后续检测。
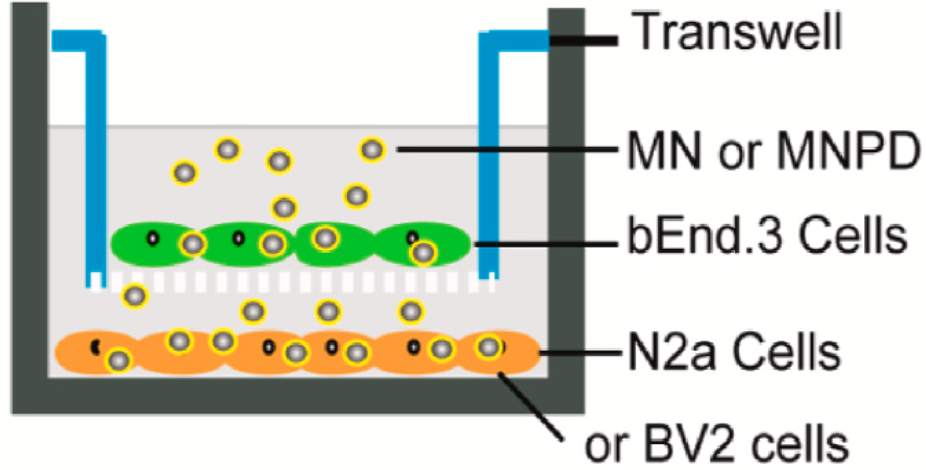
体外血脑屏障渗透模型
结果显示,与对照组(Control)和裸药组(MN)相比,12小时后,MNPD在N2a和BV2细胞中均呈现出强烈的荧光信号,这表明MPD可以有效穿过单层bEnd.3细胞屏障而被神经元细胞和小胶质细胞摄取。
活体成像结果显示,在同一时间点,MNPD组在BALB/c裸鼠大脑中的荧光信号比MN组的更强,并且在注射24小时后达到最大,表明MPD可以有效地穿透BBB而积聚在大脑。
有趣的是,与MN组相比,MNPD在大脑中的保留时间明显延长,这与小鼠体内药物代谢动力学研究的结果相吻合,血液清除曲线显示,MPD的血液循环半衰期明显延长,相对较长的循环时间为药物在大脑的渗透与累积提供了现实依据。
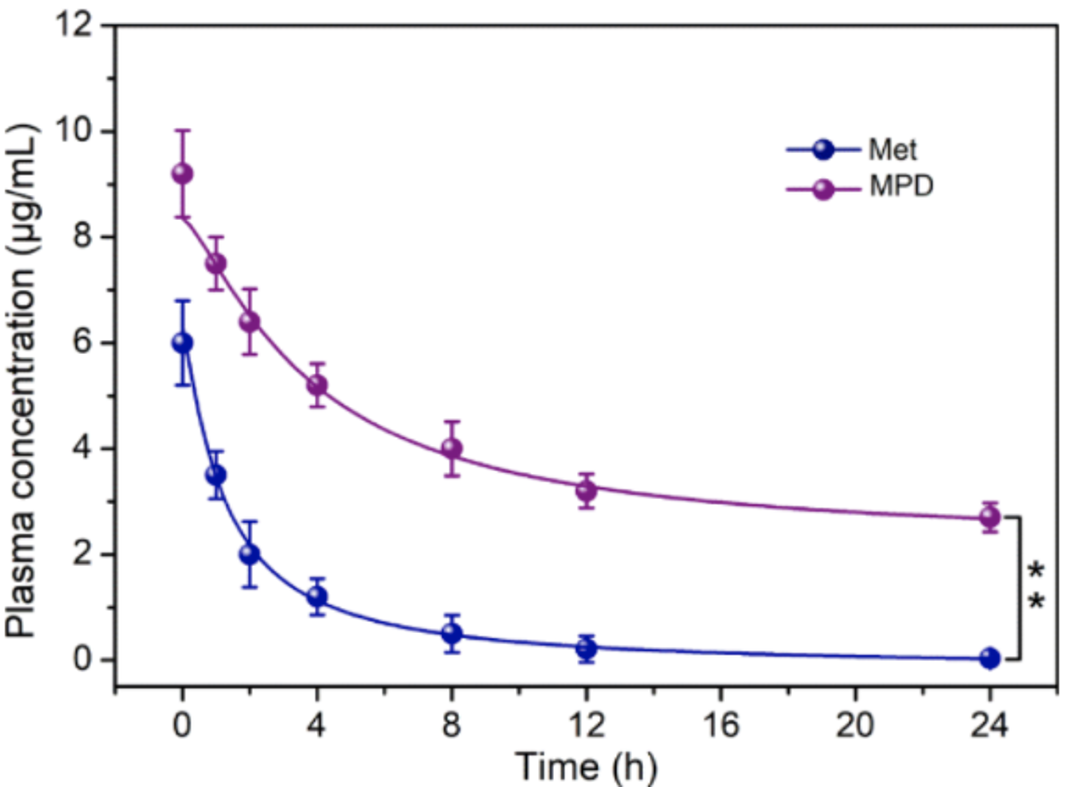
Met与MPD的血药浓度-时间曲线
受体外研究成果鼓舞,杨立朝研究员团队继续深入研究,对MPD协同抗痴呆作用在体内的效果进行了系统性探索。
首先,他们通过分析AD相关基因发现,MPD共鉴定出838个与AD相关的基因,明显超过单独给予Don治疗时鉴定出的44个基因,表明Met能够增强Don在AD治疗中的疗效。此外,京都基因和基因组百科全书(KEGG)的分析显示,AD、胆碱能突触和神经营养蛋白信号通路以及谷胱甘肽代谢在数据集中明显富集;基因本体论(GO)的分析显示,AD通路中的衰老、神经元死亡、吞噬作用、学习或记忆、神经炎症反应以及氧化还原酶活性表现出显著富集。
上述基因网络分析表明,MPD可能通过调节学习与记忆相关通路而实现协同抗痴呆作用。
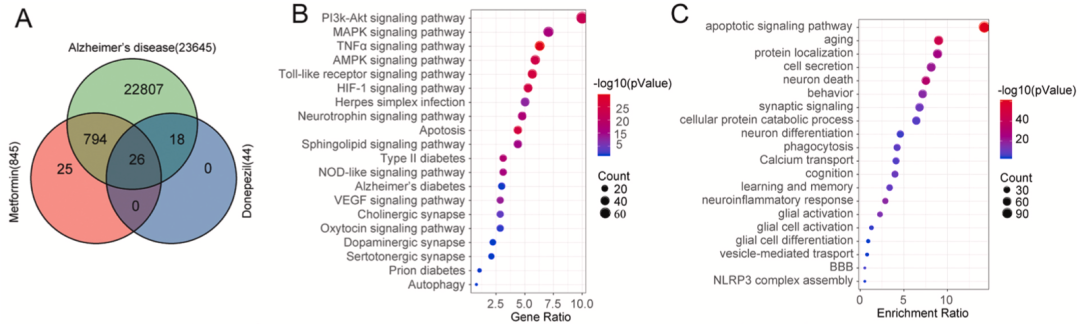
MPD可能通过调节学习与记忆相关通路而发挥抗痴呆作用
接着,杨立朝研究员等人在小鼠双侧海马区域注射Aβ25–35以建立小鼠AD模型,经过不同治疗的小鼠需接受22天Morris水迷宫(MWM)训练。
观察各组小鼠行为,他们发现,AD组小鼠的游泳痕迹均匀分布在四个象限周围,而MPD组小鼠的痕迹主要分布在目标区域,在训练期间,其逃逸潜伏期相对较短,目标平台交叉次数、在目标象限花费的时间,以及在目标象限中的距离均有增加。以上结果证明,MPD能够改善Aβ引发的认知缺陷,发挥协同抗痴呆作用。
此外,他们通过刚果红染色以及共聚焦显微镜(CLSM)观察证实,MPD能够显著降低Aβ在大脑中的沉积,同时还能提高小胶质细胞经溶酶体途径清除Aβ的效率。
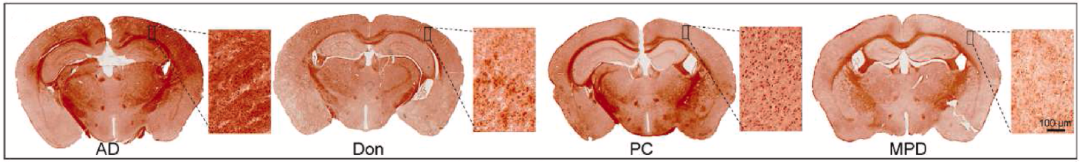
各组小鼠脑组织刚果红染色结果,MPD组Aβ沉积明显减少
有研究显示,BACE-1与PS-1增加均会提高大脑中Aβ的表达水平,而ADAM-10则能有效防止Aβ的产生[10]。
因此,杨立朝研究员等人利用蛋白免疫印迹法对以上蛋白的表达进行了检测,以表征各组小鼠脑中Aβ水平。他们发现,MPD组小鼠海马体中BACE-1与PS-1表达明显减少,而ADAM-10变化不大,表明MPD可能通过调节Aβ相关分泌酶BACE1和PS1的表达来清除过多的Aβ。
最后,研究员们对各组小鼠神经元细胞的形态及神经元特异性蛋白NeuN的表达进行了分析,证实MPD具有良好的神经保护作用,能有效改善AD小鼠的认知功能。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


