30多年前因RNA研究获得诺奖,如今再获突破,解析RNA调控的基因沉默因子,为癌症新疗法铺平道路
来源:生物世界 2024-01-03 11:06
这项研究首次在分子水平上确定了RNA如何调节PRC2活性。这一发现将促进新一代RNA疗法的发展,并可能为更有效、更有针对性地治疗PRC2缺陷相关疾病铺平道路。
近日,因发现核酶而荣获1989年诺贝尔奖的 Thomas Cech教授团队(Jiarui Song为第一作者)在 Science 期刊发表了题为:Structural basis for inactivation of PRC2 by G-quadruplex RNA 的研究论文。
该研究揭示了PRC2是如何发挥基因沉默作用的,特别是G-四链体RNA(G4 RNA)是如何帮助PRC2打开和关闭基因表达的。这一发现揭示了肿瘤的发展过程,为开发难治性癌症的新疗法了铺平道路。

1970年代,Thomas Cech 在研究四膜虫时发现RNA可以自我剪接,1982年,他首次证实RNA具有催化功能并可以参与细胞反应,也就是所谓的核酶(Ribozyme),这一发现颠覆了所有酶都是蛋白质的传统观点,也为基因工程技术带来了全新工具。1989年,他因核酶的发现获得了诺贝尔化学奖。

Thomas Cech教授
众所周知,DNA是遗传信息的载体,蛋白质是生命功能的主要承担者,而RNA是介于两者之间的传递纽带。除了作为信使来传递遗传信息,RNA还参与调节转录过程。其中,PRC2(Polycomb抑制复合物2)是一种表观遗传基因沉默复合体,对细胞分化至关重要,并且在癌症中常常发生突变。
PRC2通过组蛋白H3K27的三甲基化以沉默基因。不仅如此,PRC2还与许多前体mRNA(pre-mRNA)和长链非编码RNA(lncRNA)相关,对G4 RNA具有结合偏好。然而,对于RNA调节PRC2的机制尚不清楚。
在这项 Science 研究中,诺奖得主 Thomas Cech 领导的研究团队使用最冷冻电镜解析了PRC2的高分辨率三维结构。
之前的研究表明,PRC2这种由多种蛋白质组成的酶复合物是一种有效的基因沉默剂,可以有效地阻断基因组特定区域的通路,从而使干细胞能够分化成特定的细胞类型。例如,在发育的心脏细胞中,PRC2的沉默可能导致其分化为肾或肝细胞。
基于此,研究团队在实验室中合成了PRC2和G4 RNA ,并使用冷冻电镜在原子水平上以3.2Å的高分辨率成像,拍摄了第一张PRC2和RNA结合在一起的照片。

G4 RNA与PRC2结合的整体结构
研究团队发现,G4 RNA通过结合两个PRC2并诱导由两个催化亚基EZH2拷贝组成的蛋白质界面来介导PRC2的二聚化——EZH2结构域可以结合核小体DNA。通过这种方式,阻断了核小体DNA相互作用及其与组蛋白底物的结合,由此解释了RNA如何抑制PRC2活性。
更通俗的说,当一个RNA分子“抓住”两个PRC2蛋白时,就会像蚌壳一样以RNA为铰链将它们夹住,这样PRC2就不能与DNA相互作用。RNA就像是一个检察员,确保PRC2只作用于基因组的某些区域,并将这些区域的基因“关闭”。
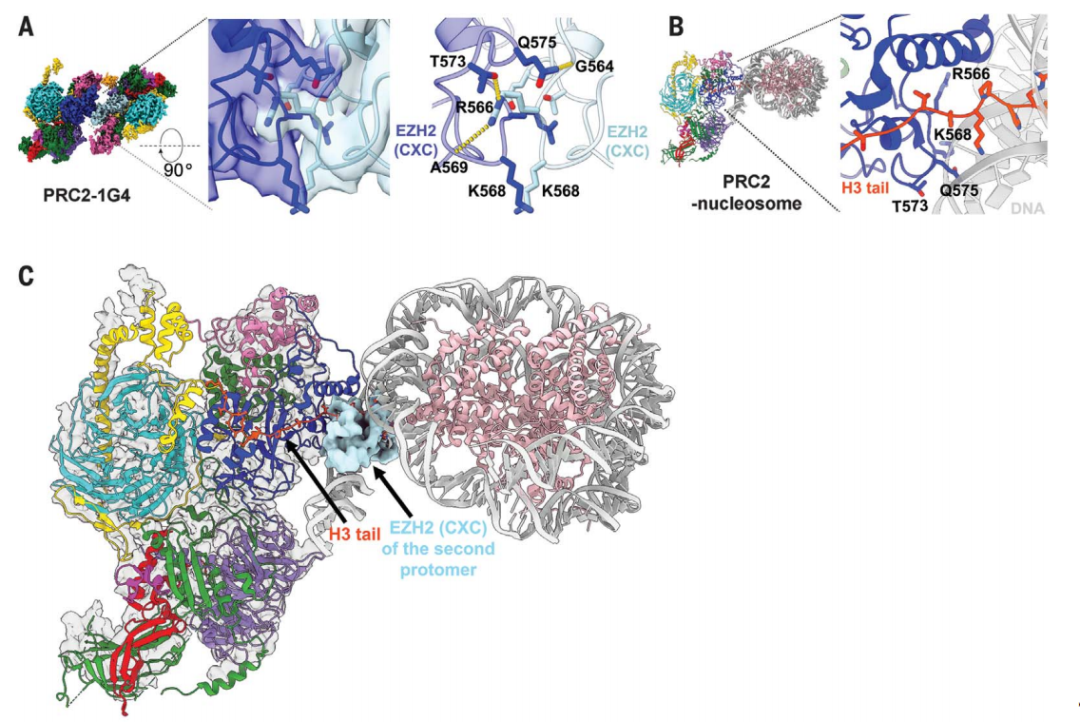
G4 RNA诱导PRC2二聚化,抑制其活性
此外,研究团队还发现,EZH2催化亚基的一个RNA结合环促进了RNA和DNA之间的转换,这是另一个与RNA调控PRC2有关的活性。研究团队在模式动物斑马鱼中发现了一个激活PRC2的功能增益突变,进一步证实了RNA介导的染色质修饰酶的调节机制。
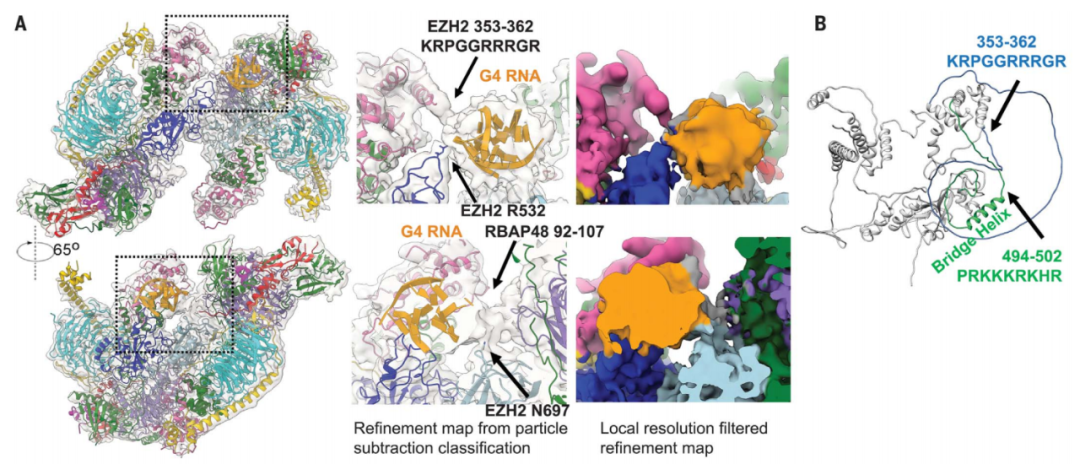
EZH2的RNA结合环与G4 RNA直接接触,促进了RNA和DNA之间的转换
总的来说,这项研究首次在分子水平上确定了RNA如何调节PRC2活性。这一发现将促进新一代RNA疗法的发展,并可能为更有效、更有针对性地治疗PRC2缺陷相关疾病铺平道路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


