GUT:华人科学家发现胃癌腹膜转移瘤中的关键免疫抑制因子!
来源:奇点糕 2022-10-20 13:06
这个研究发现了GAC腹膜转移瘤中关键的免疫抑制靶点SOX9,基于此靶点,阐明了GAC微环境中表达SOX9的肿瘤细胞,通过分泌LIF抑制CD8 T细胞应答和调节巨噬细胞功能。
胃癌是常见的消化道肿瘤之一,2020年全球范围因胃癌死亡人数位居恶性肿瘤死亡人数的第四位。胃癌中90-95%为胃腺癌(GAC),不幸的是,往往一半以上的患者被诊断为GAC时已是晚期,生存期小于六个月[1]。此外,GAC晚期患者还极其容易发生腹膜转移,目前市面上也缺乏针对GAC腹膜转移瘤的有效的靶向或免疫治疗药物。
GAC的肿瘤微环境(TME)具有高度异质性。TME中存在的肿瘤干细胞(CSCs),能够调控微环境中多种免疫细胞的功能,从而参与肿瘤的增殖和侵袭、促进肿瘤的复发和转移,导致患者对常规治疗的抵抗和不良预后[2]。
SOX家族是一类重要的干细胞转录因子,其中一些成员已被报道与肿瘤发生和转移有关[3]。SOX9已发现在多种恶性肿瘤中高表达,并发挥致癌作用。然而,在GAC腹膜转移瘤中,SOX9在肿瘤细胞的表达情况、促进播散转移的机制,以及在微环境中如何发挥免疫抑制功能的具体作用尚不清楚。
近期,来自德克萨斯大学MD安德森癌症中心的Jaffer A Ajani和Shumei Song领衔的研究团队,在Gut上发表了重要的研究成果[4]。他们发现,GAC中上调表达的SOX9基因,可调控肿瘤细胞旁分泌LIF因子,抑制瘤内CD8 T细胞应答和调节巨噬细胞功能,从而发挥免疫抑制作用。
更重要的是,联合靶向LIF/LIFR通路和巨噬细胞表面受体CSF1R,对SOX9介导的肿瘤细胞干性、T细胞免疫抑制和肿瘤转移具有很大的治疗潜力,可能成为晚期GAC的一种新的药物疗法。

论文首页截图
为了探索SOX转录因子家族在GAC腹膜转移瘤中的作用,研究团队对20例GAC患者的腹膜转移瘤组织进行了单细胞测序,他们发现,SOX9和SOX2在肿瘤细胞簇中高度富集,并且其表达水平越高也提示了患者生存期更短。
但是,通过进一步分析胃癌TCGA数据和验证队列样本的组织染色,他们发现只有SOX9在肿瘤组织中的表达明显高于正常组织或癌旁组织。同时,高表达SOX9的胃癌患者也显示出更短的生存期。此外,免疫荧光染色发现,GAC患者的原位癌或者腹膜转移瘤组织中,SOX9在恶性肿瘤细胞的细胞核中表达丰富,而在免疫细胞中表达较低。
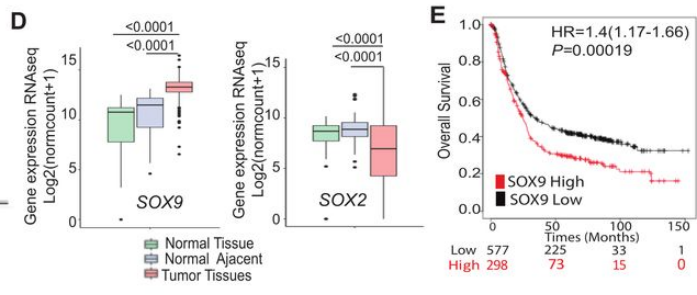
SOX9在GAC肿瘤细胞中高表达,与不良预后相关
为了进一步探究SOX9在GAC腹膜转移瘤中对CSCs的调控作用,研究团队分析了GAC腹膜转移瘤样本测序数据,他们发现,SOX9和其他一些CSC相关的基因聚类在同一肿瘤细胞群中。
CSCs是一群保留干细胞特性,具备自我更新能力的细胞群。他们将两种GAC腹膜转移瘤细胞系GA0518和AGS进行了SOX9基因敲除(KO),与对照细胞相比,SOX9 KO肿瘤细胞的自我更新能力显著削弱,SOX9 KO细胞在异种移植模型小鼠体内的成瘤能力和转移扩散能力都显著降低。
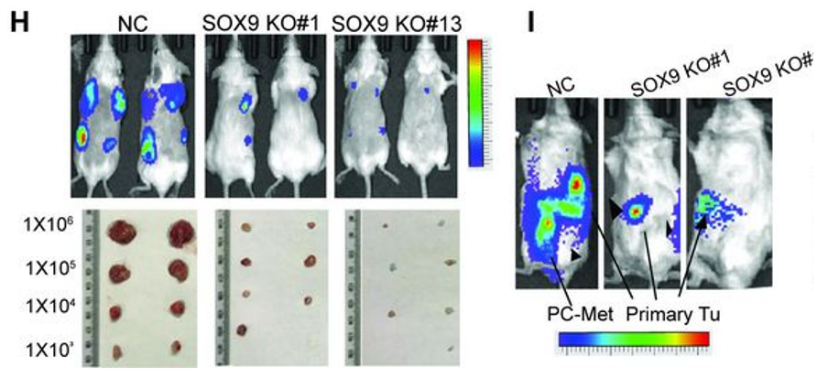
SOX9调控GAC中CSC成瘤能力及转移
证实了SOX9在维持GAC肿瘤细胞的干性、侵袭性和促进播散转移中发挥重要作用后,研究团队想进一步探索SOX9在肿瘤免疫抑制微环境中的潜在作用。首先,他们对胃癌的TCGA数据进行分析,发现SOX9与CD8 T细胞浸润或者CD3D和CD8A表达呈负相关。
接着,他们将GA0518 SOX9 KO细胞、GA0518对照细胞和来自GAC患者的外周血单个核细胞(PBMCs)进行共培养。流式分析发现,与对照细胞相比,PBMCs与GA0518 SOX9 KO细胞共培养时CD8 T细胞的数量和效应分子(颗粒酶B、穿孔素和干扰素γ)表达均增加。
此外,用SOX9 KO的培养上清预处理PBMCs后,T细胞对靶细胞 (GA0518-Luc)的杀伤能力也增强了。这些结果表明,SOX9可能调控肿瘤细胞分泌某些因子,从而抑制CD8 T细胞的细胞毒活性。
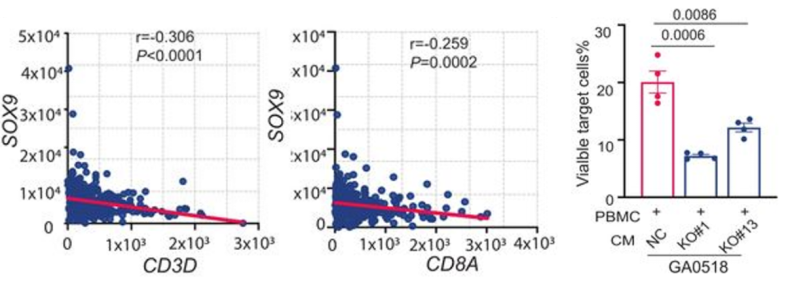
SOX9在抑制GAC腹膜转移瘤的CD8 T细胞功能中起重要作用
所以,SOX9到底是通过什么机制来抑制GAC腹膜转移瘤中CD8 T细胞功能呢?
研究团队发现,在SOX9 KO细胞中,LIF是表达下调程度最高的基因之一,并且表达LIF更高的GAC患者也显示出更短的生存期。LIF是IL-6家族的成员,已有研究证实,LIF可通过其受体LIFR和GP130激活肿瘤细胞中的信号通路,发挥致瘤作用[5]。
为了进一步验证SOX9和LIF的表达相关性,他们检测了GAC腹膜转移瘤患者的肿瘤样本,发现SOX9和LIF在肿瘤细胞上共表达,并且患者的腹水中的LIF水平明显升高,而LIF水平较高的患者生存期更短。
这些结果说明,SOX9调控表达的LIF,也是GAC腹膜转移瘤的一个不良预后的指标。
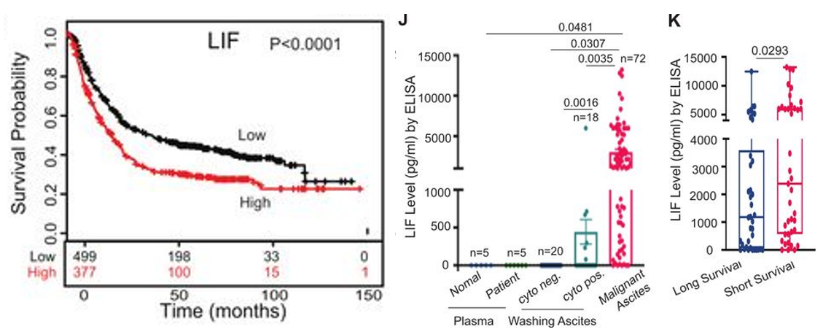
LIF是SOX9调控分泌的主要因子,与患者不良预后相关
肿瘤相关巨噬细胞(TAMs),是TME中与CSCs相互作用,参与肿瘤转移的关键免疫细胞介质[6]。TAMs主要分为,发挥促炎作用的M1型巨噬细胞和发挥免疫抑制作用的M2巨噬细胞[7]。那么SOX9是否也参与调控TAMs的表型和功能,从而促进GAC的腹膜转移呢?
通过分析GAC腹膜转移瘤患者的单细胞测序数据,他们发现瘤内巨噬细胞的富集程度与患者的存活期有关,并且CD163 M2巨噬细胞还高表达CSF1R、CCL2和IL10。他们用SOX9 KO细胞培养上清预处理M1巨噬细胞(由U937单核细胞体外诱导分化),发现巨噬细胞CCL2和IL-10(是两种M2巨噬细胞分泌并介导免疫抑制的细胞因子)表达显著降低,并且使用LIF/LIFR抑制剂(EC359)同样可以减少CCL2和IL-10水平。此外,CSF1R抑制剂(PLX3397)也可以抑制CCL2表达。
这些结果说明,SOX9调控表达的LIF,的确能够促进微环境中M2巨噬细胞分化和产生。
更重要的是,LIF/LIFR抑制剂(EC359)同样可以恢复GAC腹膜转移瘤中CD8T细胞的杀伤功能。
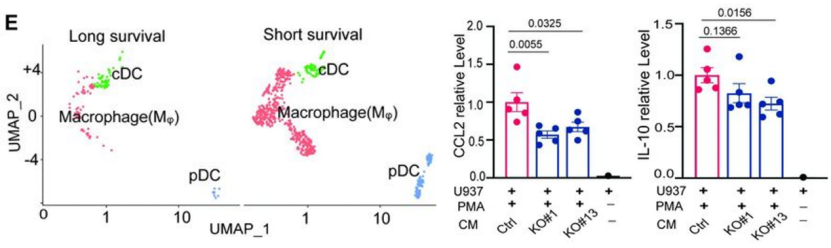
抑制LIF/LIFR降低SOX9诱导的M2型巨噬细胞产生CCL2和IL-10
TAMs也是当前肿瘤免疫治疗的重要靶点,其中,可以阻断巨噬细胞的扩张和分化的CSF1R抑制剂(PLX3397)已进入多项临床试验。为了促进SOX9作为治疗靶点的临床转化,研究团队继续应用LIF/LIFR抑制剂(EC359)和CSF1R抑制剂(PLX3397),观察对GAC小鼠肿瘤生长和转移的影响。
他们发现,无论是皮下种植瘤,还是腹膜转移瘤模型,EC359和PLX3397联合治疗产生了比单独治疗更好的抗肿瘤效果。联合治疗显著降低了腹膜转移,延长了荷瘤小鼠的生存期。
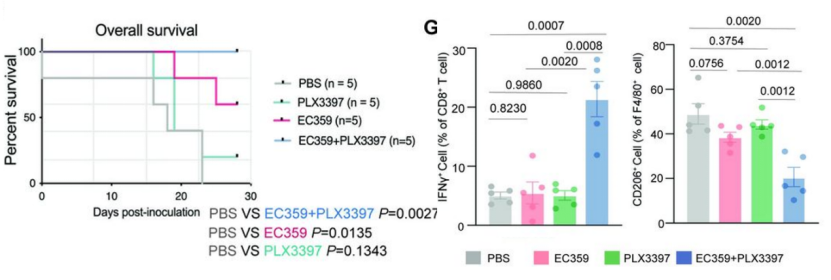
小鼠KP-Luc2胃癌模型中,联合抑制SOX9/LIF和M2巨噬细胞可增强固有免疫和T细胞应答
这个研究首次报道了SOX9基因在GAC腹膜转移瘤中发挥免疫抑制作用,并阐明了SOX9作为肿瘤干细胞基因,调控肿瘤细胞、T细胞和巨噬细胞之间的相互作用,进而促进肿瘤免疫逃逸和扩散转移。

机制示意图
总的来讲,这个研究发现了GAC腹膜转移瘤中关键的免疫抑制靶点SOX9,基于此靶点,阐明了GAC微环境中表达SOX9的肿瘤细胞,通过分泌LIF抑制CD8 T细胞应答和调节巨噬细胞功能。这个研究揭示了SOX9不仅可作为胃癌肿瘤干细胞的作用靶点,并且联合靶向LIF/LIFR和CSF1R可抑制胃腺癌的腹膜转移,极具临床转化的价值和潜力。
参考文献
[1] Joshi SS, Badgwell BD. Current treatment and recent progress in gastric cancer. CA Cancer J Clin. 2021;71(3):264-279. doi:10.3322/caac.21657
[2] Bayik D, Lathia JD. Cancer stem cell-immune cell crosstalk in tumour progression. Nat Rev Cancer. 2021;21(8):526-536. doi:10.1038/s41568-021-00366-w
[3] Grimm D, Bauer J, Wise P, et al. The role of SOX family members in solid tumours and metastasis. Semin Cancer Biol. 2020;67(Pt1):122-153. doi:10.1016/j.semcancer.2019.03.004
[4] Fan Y, Li Y, Yao X, et al. Epithelial SOX9 drives progression and metastases of gastric adenocarcinoma by promoting immunosuppressive tumour microenvironment. Gut. 2022;gutjnl-2021-326581. doi:10.1136/gutjnl-2021-326581
[5] Bian SB, Yang Y, Liang WQ, Zhang KC, Chen L, Zhang ZT. Leukemia inhibitory factor promotes gastric cancer cell proliferation, migration, and invasion via the LIFR-Hippo-YAP pathway. Ann N Y Acad Sci. 2021;1484(1):74-89. doi:10.1111/nyas.14466
[6] DeNardo DG, Ruffell B. Macrophages as regulators of tumour immunity and immunotherapy. Nat Rev Immunol. 2019;19(6):369-382. doi:10.1038/s41577-019-0127-6
[7] Bayik D, Lathia JD. Cancer stem cell-immune cell crosstalk in tumour progression. Nat Rev Cancer. 2021;21(8):526-536. doi:10.1038/s41568-021-00366-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


