PNAS:肿瘤“自产自销”免疫激活剂——MIT新疗法让癌细胞“自掘坟墓”!
来源:生物谷原创 2025-11-11 09:50
来自麻省理工学院等机构的科学家们通过让癌细胞“自产”免疫激活分子,成功实现了“以子之矛,攻子之盾”的抗癌新策略。
作为全球第二大致死原因,癌症每年会导致近千万人死亡,WHO数据显示,2022年全球新发癌症病例超过2000万,其中肺癌、乳腺癌、结直肠癌等位居前列。尽管免疫疗法(尤其是免疫检查点抑制剂)已在多种癌症中展现出显著疗效,但响应率低、系统性毒性强等问题仍是当前临床面临的重大挑战。
在肿瘤微环境中,癌细胞虽占据“半壁江山”,却常因信号通路缺陷而沦为免疫治疗的“旁观者”。如何激活肿瘤内部的免疫应答同时避免全身性副作用已经成为学界聚焦的前沿热点。
近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Restoration of cGAS in cancer cells promotes antitumor immunity via transfer of cancer cell–generated cGAMP”的研究报告中,来自麻省理工学院等机构的科学家们通过让癌细胞“自产”免疫激活分子,成功实现了“以子之矛,攻子之盾”的抗癌新策略。
借力打力,让癌细胞“自我背叛”
(1)巧用cGAS-STING通路:从“旁观”到“主演”
STING(干扰素基因刺激因子)是天然免疫的关键蛋白,其激活可启动干扰素等细胞因子释放从而招募T细胞、NK细胞等“免疫大军”攻击肿瘤;然而,传统STING激动剂虽在动物实验中表现优异,临床却因需大剂量注射、易引发全身炎症反应而受限。
这项研究中,研究人员另辟蹊径,他们不直接注射STING激动剂,而是利用mRNA技术让癌细胞自行生产其天然激动剂cGAMP;具体而言,他们将编码cGAS(合成cGAMP的关键酶)的mRNA包裹于脂质纳米颗粒并精准递送至癌细胞。一旦进入,cGAS便利用癌细胞中丰富的双链DNA碎片(快速分裂的副产物)合成cGAMP,后者分泌至微环境后,激活周边免疫细胞的STING通路。
(2)双重机制增效,联合治疗显神威
在黑色素瘤小鼠模型中,单独使用cGAS mRNA或PD-1抑制剂均能显著抑制肿瘤生长,但二者联用则实现30%小鼠的肿瘤完全消退;进一步分析显示,该疗法不仅能激活CD8+T细胞、NK细胞等“杀伤部队”,还能显著提升树突状细胞、巨噬细胞的抗原呈递能力,形成“多方围剿”之势。
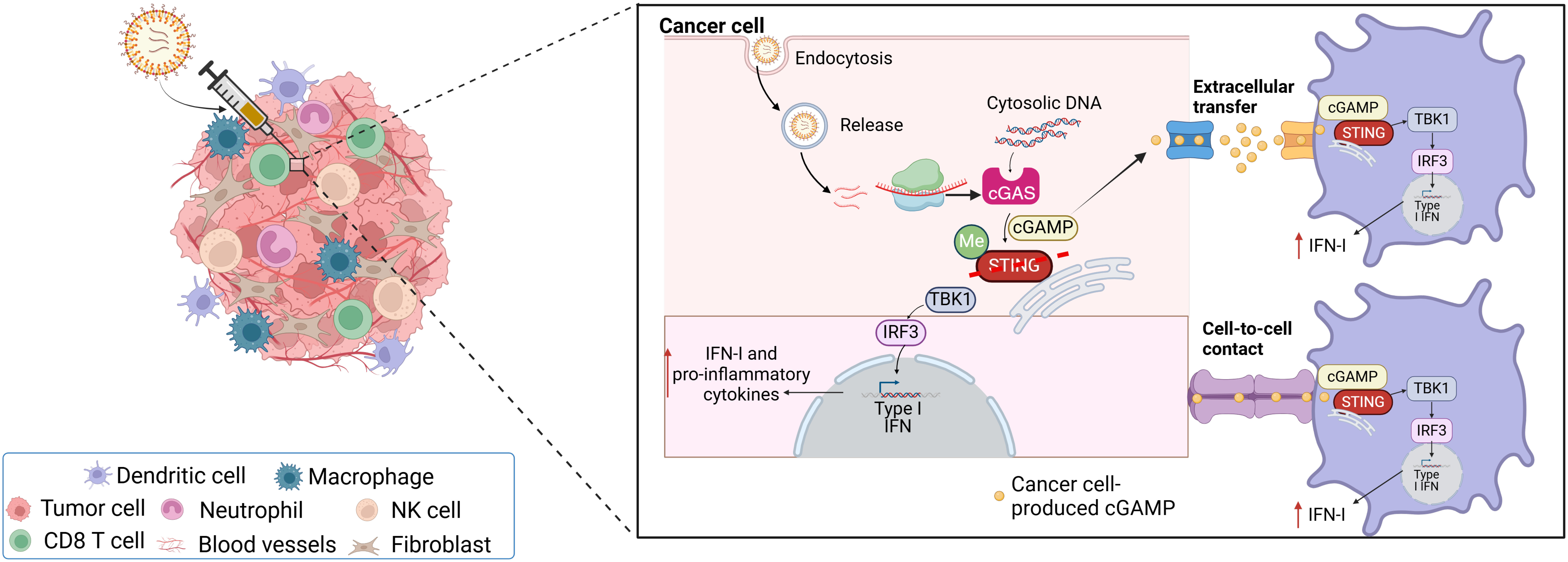
癌细胞的cGAS或能作为免疫疗法的来源
(3)低毒高效,突破临床瓶颈
与传统注射cGAMP相比,该策略仅需极低剂量即可起效且纳米颗粒将mRNA与cGAMP“锁”在肿瘤局部,从而就避免全身扩散导致的组织损伤和自身免疫反应。研究者Alexander Cryer形象地解释:“这好比在肿瘤内部建了一座“制药工厂”,省去了外部运输的损耗与风险。”
从“靶向递送”到“就地取材”的范式革新
这项研究的核心突破在于将癌细胞从免疫逃逸的“帮凶”转化为免疫激活的“功臣”。研究人员不仅利用了癌细胞的数量优势,还规避了其常见的cGAS信号缺陷,通过“就地生产”cGAMP从而实现高效、低毒的免疫激活。此外,该平台具有高度扩展性,即通过替换mRNA编码序列就能让癌细胞生产其他免疫调节分子,从而为联合放疗、化疗等DNA损伤疗法奠定基础。下一步研究人员还计划开发静脉注射剂型从而推动其向临床转化。
癌症治疗的“田园智慧”?
中国有句古话,借力打力,四两拨千斤;这项研究恰似在肿瘤内部播下“免疫种子”,借助癌细胞自身的养分培育出摧毁它们的“免疫森林”。随着mRNA技术与免疫治疗的深度融合,未来或许我们不再需要“强攻”肿瘤,而是学会“智取”让癌症在自身的混乱中走向终结。(生物谷Bioon.com)
参考文献:
Alexander M. Cryer,Pere Dosta,Michelle Z. Dion, et al. Restoration of cGAS in cancer cells promotes antitumor immunity via transfer of cancer cell–generated cGAMP. Proceedings of the National Academy of Sciences.2025,doi:10.1073/pnas.2409556122
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


