柳叶刀综述:mRNA癌症疫苗的递送及临床进展
来源:金斯瑞生物 2022-11-07 17:34
新冠肺炎大流行使得mRNA疫苗成为全球关注的焦点。事实上,新冠肺炎疫苗的快速发展得益于多年来在临床前和临床试验中以mRNA疫苗作为癌症治疗策略的相关研究。
新冠肺炎大流行使得mRNA疫苗成为全球关注的焦点。事实上,新冠肺炎疫苗的快速发展得益于多年来在临床前和临床试验中以mRNA疫苗作为癌症治疗策略的相关研究。mRNA在疫苗接种过程中具有如下优势:首先,mRNA疫苗耐受性好、容易降解、不易整合到宿主基因组中;其次,mRNA分子是非传染性的,具有激发体液免疫和细胞免疫的潜力;最后,mRNA疫苗的生产速度快、成本低。
1996年,第一个基于mRNA的癌症疫苗研究首先在树突状细胞(DC)中进行了体外实验。如今,科学技术的进步使mRNA的结构、稳定性、注射方式得到多方面优化,多项临床试验都正在招募癌症患者进行mRNA疫苗治疗。 
 部分正在进行的mRNA癌症疫苗临床实验
部分正在进行的mRNA癌症疫苗临床实验
mRNA可以通过皮内、皮下、鼻内、结节内、肌肉内、瘤内和静脉给药等方式进行给药。带有mRNA的自体树突状细胞体外工程一直是肿瘤抗原递送的首选方法,但是目前大多数mRNA疫苗都利用脂质纳米颗粒制剂为载体进行直接注射给药。
mRNA疫苗的临床疗效和免疫原性已经在癌症诊断和给药方式中进行了相关评估。一些试验报告显示,癌症患者在接受mRNA疫苗治疗后,产生了持久的免疫能力,且无难以控制的毒副作用。mRNA疫苗是未来癌症治疗的有希望的候选疗法,特别是在与其他免疫疗法结合使用的场景下。然而,目前正在进行的mRNA癌症疫苗研究均没有到达临床III期。在本文发布时,还没有用于治疗癌症的mRNA疫苗获得上市批准。本文总结了治疗性mRNA癌症疫苗的最新临床进展,重点介绍了mRNA疫苗的递送方式。

基于mRNA的癌症疫苗试验
mRNA疫苗接种的目的是诱导或促进有效的抗肿瘤免疫反应。编码了肿瘤相关或肿瘤特异性抗原的人工合成mRNA是通过体外工程的自体树突细胞或通过封装或非封装的mRNA注射进行递送。在接种疫苗和被抗原提呈细胞摄取后,mRNA被转运到细胞质中,经过抗原处理后引发MHC呈递级联效应。因此,抗原呈递细胞在MHC I类和MHC II类上呈递肿瘤相关抗原后可以激活CD8+和CD4+T细胞。此外,CD4+T细胞可以共激活抗原特异性B细胞并诱导体液免疫反应。作为抗原提呈细胞的B细胞在内化细胞外蛋白并呈递到B细胞的MHC II类后,可以反过来激活CD4+T细胞。
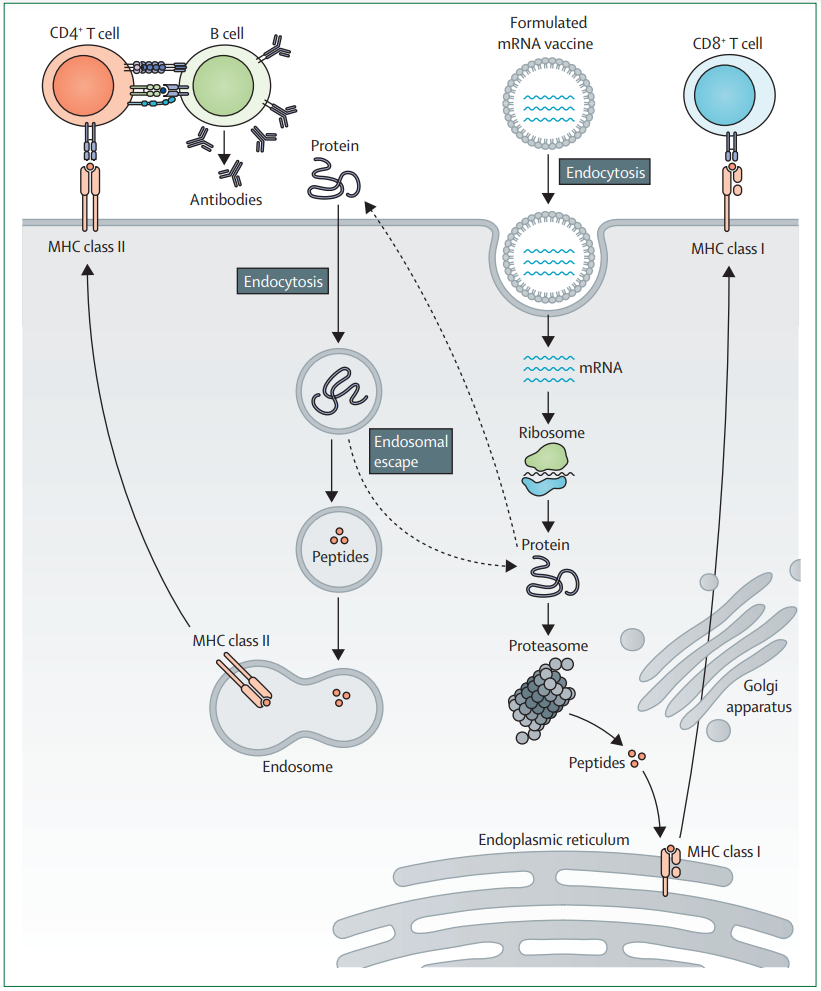
基于mRNA的疫苗作用模式
目前,有多个抗肿瘤的mRNA癌症疫苗治疗研究临床试验(例如,NCT04534205、NCT03313778和NCT04503278) 正在招募自愿患者。
未封装(裸露)的mRNA癌症疫苗
裸露的或未封装的mRNA疫苗将mRNA分子保存在缓冲溶液中,这种疫苗可以通过皮内或结节内注射。裸mRNA在结节内给药可以在T细胞激活的实际位置将抗原传递给抗原呈递细胞,从而避免了对抗原呈递细胞迁移的要求。多项研究表明,树突细胞可以摄取结节内注射的裸mRNA,并产生有效的抗肿瘤T细胞反应。
过去5年只有几项临床试验用裸mRNA疫苗治疗癌症。在一个I期临床试验中,13名III或IV期黑色素瘤患者接受了裸mRNA疫苗的结节内注射,这些患者在之前的治疗后病情稳定、部分缓解或完全缓解。这种新表位靶向疫苗编码了独特的且个性化的肿瘤突变特征,每个患者选定10个新表位靶向疫苗。所有患者都对众多疫苗编码的新表位产生了T细胞反应,在5例IV期黑色素瘤患者中有2例(40%)观察到与疫苗相关的临床反应。在最近结束的I期临床试验 (NCT03394937) 中,20名切除黑色素瘤的患者(IIc、III和IV期)接受了裸mRNA疫苗(ECI-006)的结节内注射。该疫苗包括编码3个树突细胞激活分子(TriMix)和5个肿瘤相关抗原的mRNA。在第2个研究队列(NCT03394937)中,经过3-12个月标准治疗后病情稳定的转移性黑色素瘤患者接受了ECI-006疫苗和标准抗PD-1疗法的联合治疗,目前结果尚未公布。在ClinicalTrials.gov注册的临床试验,当下没有招募患者进行裸mRNA癌症疫苗治疗。
封装的mRNA癌症疫苗
裸露的mRNA很容易被细胞外的RNA酶降解。因此,学者们已经开发了几种纳米载体药物系统,它们通常含有多肽或脂类等聚合物,以优化mRNA的保存并促进抗原呈递细胞对mRNA的摄取。
鱼精蛋白封装的mRNA癌症疫苗
鱼精蛋白是带正电荷的聚阳离子多肽,它与带负电荷的信使核糖核酸形成络合物,保护分子免受降解。鱼精蛋白封装的mRNA疫苗以RNActive疫苗的形式在不同的临床试验中进行了评估。RNA活性疫苗将核苷酸修饰的mRNA分子与鱼精蛋白复合,以提高蛋白质表达和免疫原性。在撰写本文时,尚无在ClinicalTrials.gov注册的,正在招募患者进行鱼精蛋白制剂mRNA癌症疫苗研究的临床实验。
在一项安慰剂控制的I/II期临床研究中,一种编码6种前列腺癌特异性抗原的RNActive疫苗(CV9104)被用于转移性前列腺癌患者研究。在临床上,疫苗是安全的,但与安慰剂组相比,并无提高总体存活率和无进展存活率。
也有学者运用RNActive免疫技术在非小细胞肺癌(NSCLC)患者中进行了I/II期剂量递增试验临床研究。患者在一线治疗后病情稳定,才接受编码五种非小细胞肺癌肿瘤相关抗原的鱼精蛋白封装的mRNA疫苗(CV9201)。7名IIIb期非小细胞肺癌患者和39名IV期非小细胞肺癌患者接受了5次CV9201皮内注射。结果显示疫苗的耐受性良好。在30名可评估的患者中,有19名患者(63%)检测到对至少一种肿瘤相关抗原的T细胞反应,但与历史对照组相比,该疗法并未提高总体存活率。第三项Ib期临床试验评估了RNActive疫苗与局部放射相结合治疗IV期非小细胞肺癌患者的效果。在这项试验中,编码六种肿瘤相关抗原的RNActive(CV9202;CV9201中使用的五种肿瘤相关抗原加上MUC-1中使用的肿瘤相关抗原)通过皮内注射方式给药。根据非小细胞肺癌的病理类型,将患者分为三组。三组患者中有两组继续接受化疗或酪氨酸激酶抑制剂治疗。疫苗治疗耐受性良好,在25名可评估的患者中,有21名患者(84%)检测到CV9202抗原特异性免疫,1名患者(3.8%)部分缓解,26名可评估患者中有12名(46.2%)患者达到疾病稳定状态。CV9202疫苗还在最近完成的一项I/II期临床研究(NCT03164772)中进行了评估,在该研究中,转移性非小细胞肺癌患者接受了CV9202与德瓦鲁单抗(PD-L1抗体)或德瓦鲁单抗+替西木单抗(抗CTLA-4抗体)的联合治疗,但结果尚未公布。
mRNA脂质复合体疫苗
mRNA脂质复合疫苗利用一种混合载体进行递送,这种载体在脂质外壳内结合mRNA复合物和聚阳离子成分。带正电荷的阳离子脂质自然地与带负电的mRNA形成复合物并促进抗原呈递细胞的内吞作用,因此通常用于脂质复合物的构建。
一项I期剂量递增试验(NCT02410733)评估了mRNA脂质复合疫苗(BNT111)的安全性和有效性,这种疫苗编码的四种黑色素瘤相关抗原至少有一种与晚期黑色素瘤患者中的抗原相关。在一系列共享癌症抗原(FixVac)固定组合的mRNA疫苗中,BNT111是其中第一种包含了共享肿瘤相关抗原的固定组合的疫苗。在50例患者中有超过39例患者(75%)被检测到对一种或多种肿瘤相关抗原产生免疫应答,在此过程中,BNT111能够诱导CD4+和CD8+T细胞应答。有17例患者接受了BNT111与抗PD-1联合治疗,这些患者中有6例(35%)患者产生了部分反应,2例(12%)患者病情稳定。25例患者单独给予BNT111治疗,其中3例(12%)患者病情得到部分缓解,7例(28%)患者病情稳定。目前有一项随机II期临床试验(NCT04526899)正在对FixVac BNT111进行评估,该试验单独使用BNT111或与抗PD-1抗体cemiplimab联用,用以治疗难以通过抗PD-1抗体治愈的或复发性不可切除的III期和IV期黑色素瘤患者。
多项正在开展中的临床试验正在积极地评估FixVac mRNA脂质复合疫苗。一项I/II期四分支扩展试验(NCT04382898)正在评估癌症疫苗BNT112,该疫苗编码五种肿瘤相关抗原,其单独使用或与cemiplimab联合用于治疗转移性前列腺癌患者。FixVac BNT115编码三种卵巢特异性肿瘤相关抗原,目前正在一项I期研究(NCT04163094)中接受评估,该疫苗在卵巢癌患者接受辅助化疗前使用,或与辅助化疗、新辅助化疗联合使用。一项随机II期临床试验(NCT04534205)正在评估BNT113,这是一种由抗人乳头瘤病毒(HPV)-16衍生的编码癌蛋白的mRNA ,其与PD-1抑制剂pembrolizumab联合用于治疗 HPV16阳性和PD-L1阳性患者的头颈部鳞状细胞癌。BNT113 还在一项两分支的I/II期疫苗剂量递增研究(NCT03418480)中接受评估,该试验将评估BNT113 对有既往疗史的 HPV16 阳性头颈部鳞状细胞癌患者或 HPV16 阳性头颈部鳞状细胞癌晚期患者的疗效。第五项临床试验(NCT05142189)正在对FixVac疫苗BNT116进行评估,该试验使BNT116与pembrolizumab或Docetaxel联用,在晚期或转移性NSCLC患者中开展I期临床研究。
除了FixVac疫苗之外,还有几项研究正在探索一种被称为个体化新抗原特异性免疫疗法(iNeST)或BNT122的mRNA脂质复合疫苗平台。iNeST包括编码个体肿瘤突变的mRNA脂质复合疫苗,该疫苗正在参与多个实体瘤诊断的临床试验(NCT03289962、NCT03815058、NCT04486378和NCT04161755)。针对三阴性乳腺癌患者(NCT02316457)群体,iNeST正在与另一种脂质体合成的编码肿瘤相关抗原的mRNA(BNT114)和编码p53的RNA联用进行药效评估(NCT02316457)。最后,一项正在进行的I/II期临床研究(NCT04503278) 正在研究一种CLDN6编码的mRNA脂质复合疫苗CARvac,该疫苗可用于治疗复发或难治性CLDN6阳性晚期实体瘤患者。CARVac与靶向CAR-T细胞疗法的自体CLDN6(BNT211)联合静脉注射,旨在改善CAR-T细胞疗法。早期数据显示,在接受 CLDN6 CAR-T细胞治疗以及与ARVac联合治疗的7名可评估患者中,有4名(57%)患者病情得到部分缓解,1名(14%)患者在6周评估时病情稳定,在为期12周的评估中报告了缓解反应。疗效数据显示,在评估的患者中没有出现剂量限制、药物相关的严重不良事件。在8名患者中仅观察到可控制的低水平细胞因子释放综合征。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


