iScience:清华大学鲁白团队开发一种新型精神分裂症动物模型
来源:生物世界 2022-06-23 15:42
该论文报道了 Bdnf-e6 和发育中的不良环境压力的组合,导致了小鼠产生了类精神分裂的行为。基于此 G×E 的组合,开发了一种全新的精分动物模型,并在此模型验证了两种潜在药物的治疗策略。
精神分裂症(Schizophrenia)是一种极具破坏性的精神疾病,不仅给患者带来严重痛苦,也是巨大的社会和经济负担。精分病人具有阳性症状(妄想、思维和言语紊乱)、阴性症状(缺乏情感、无社会性和动机缺乏)和认知功能障碍等三大症状。精神分裂症具有相当大的异质性,一般认为遗传与环境因素在其发病机制中都起到重要作用。
近年的大规模全基因组关联分析揭示了很多精分的风险基因,但却一直没有找到真正致病的基因。也有一种理论认为,发育时不良环境风险,如缺氧、营养不良等因素是发病的诱因。但是,具体哪些基因和什么样的环境因素之间相互作用能导致精分,仍然是该领域的一个重大难题。
正因如此,目前上市的药物都只是治标,没有一种药物可以真正全面的缓解三大症状,从而达到治疗的作用。大多数精分药物不仅收效甚微,还存在严重的副作用。
精分药物研发的最大障碍之一是缺乏真正能模拟病理特征的动物模型。一个优秀的动物模型,需要具备三个方面的特征:表型模拟(Face Validity),即与人类疾病在表征上相似,包括生化指标、细胞学、病理、行为症状等;机理模拟(Construct Validity),即基于人类发病机理构建的;预见性(Predictive Validity),即在该模型是能够筛选,验证药物,预测在病人临床试验中的药物疗效。而迄今为止所有的精分动物模型,没有一种是三方面特征都具有的。另外,动物无法展示幻觉,妄想,意志缺乏。此外,致病因素的异质性也使得转基因和药物诱导为主的精分动物模型精分病人的实际情况大相径庭,未能在药物研发中起到很好的作用。
随着对精分认识的不断加深,目前专家们开始接受所谓“双重打击”的假说,即某种遗传因素(G)和环境风险因子(E)的相互作用,最终导致了精分的发病。该假说的难点是找到精分遗传基因和环境风险因子的组合(G×E)。
清华大学鲁白教授提出,脑源性神经营养因子(BDNF)基因的一个亚型和发育中个体所受的伤害性环境压力的相互作用,是导致精分的一对 G 和 E 的特殊组合。
2022年6月16日,鲁白实验室在Cell子刊 iScience 上发表了题为:Corticosterone antagonist or TrkB agonist attenuates schizophrenia-like behavior in a mouse model combining Bdnf-e6 deficiency and developmental stress 的研究论文,
该论文报道了 Bdnf-e6 和发育中的不良环境压力的组合,导致了小鼠产生了类精神分裂的行为。基于此 G×E 的组合,开发了一种全新的精分动物模型,并在此模型验证了两种潜在药物的治疗策略。
这也是鲁白教授团队继成功开发了全面模拟人类阿尔茨海默病大鼠模型(AD rat model)之后,又成功开发的一个新的疾病动物模型。

临床流行病学和全基因组研究表明,BDNF 基因(Bdnf)与精分发病密切相关,但其在精分中起效的具体分子机制尚未明确。其中一个最主要的原因是,Bdnf 具有复杂且罕见的基因结构,共有9个启动子,可分别启动其下游9个非编码外显子,并通过可变性剪接(Alternative Splicing)的方式连接到第10个编码 BDNF 蛋白的外显子上。也就是说,在动物(人)的大脑中,一共有9种不同的 Bdnf mRNAs,但只编码同一种 BDNF 蛋白。
究竟哪一种 Bdnf mRNA 是精分的关键遗传因素?
鲁白团队经过多年努力,用基因敲除技术将9个 Bdnf mRNAs 中与大脑疾病最相关的4个分别敲除,构建了4种小鼠模型(BDNF-e1、BDNF-e2、BDNF-e4和BDNF-e6)。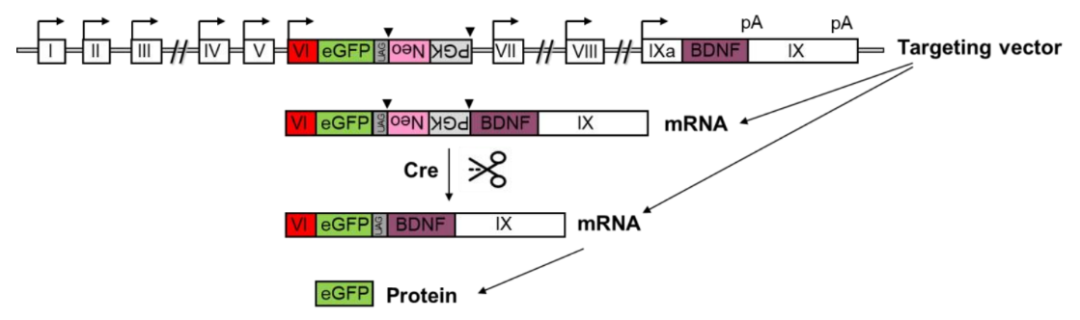
图1:BDNF-e6敲除小鼠的构建策略
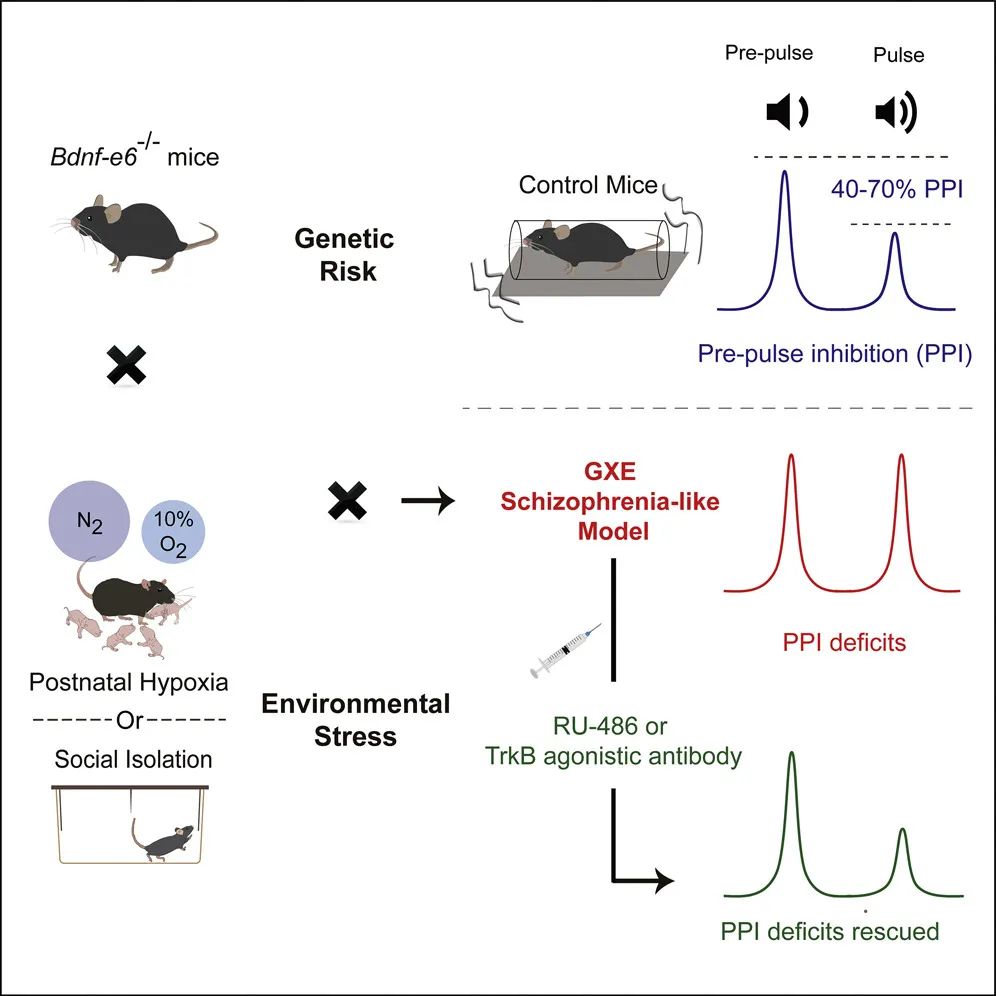
在这项研究中,鲁白实验室发现,敲除第6个 Bdnf mRNA,即 BDNF-e6 的缺陷,很可能是“双重打击”中的‘第一次打击(G)’,而发育过程中的常见的造成环境紧张的因素,如产后缺氧和断奶后社交隔离,可能是精分的‘第二次打击(E)’。通过诸多行为学检测手段,如旷场实验(Open field test,检测小鼠在新异环境中的自主行为、探究行为和紧张度)、三箱社交实验(Three-Chamber test,检测小鼠的社交能力和对新社交对象的偏好)、前脉冲抑制实验(Prepulse inhibition test,PPI,检测小鼠的感觉运动门控功能)、水迷宫(Morris water maze,检测小鼠的学习记忆能力)等,观察到对人类精神分裂症有警示意义的现象:即单独的BDNF-e6缺陷或者单独的早期发育过程中的紧张,都不足以引起精分的相关症状。
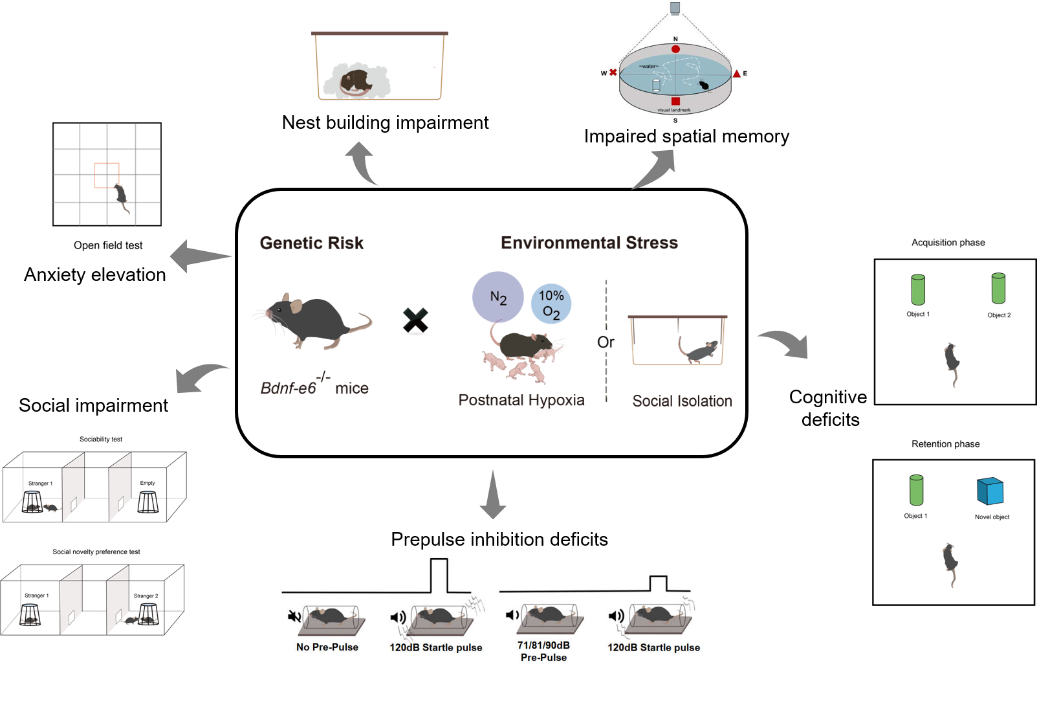
图2:“双重打击”的精分模型中小鼠的行为缺陷
而只有两者的结合,即在 BDNF-e6 缺陷的小鼠发育过程中给与产后缺氧和断奶后社交隔离,才能造成类似精分的行为。该实验首次证明基因和环境对于精分症状的产生缺一不可,并找到了一对造成精分的关键基因(G,BDNF-e6)和环境(E,产后缺氧和断奶后社交隔离)因素。
进一步研究表明,上述提及的两种环境风险因素,即产后缺氧和断奶后社交隔离,均会导致小鼠血清中应激激素皮质酮(corticosterone)水平的上升。那么,是否给 BDNF-e6 缺陷小鼠长期服用皮质酮,即可取代压力刺激,诱导类精分行为呢?
果然,BDNF-e6 缺陷小鼠即使不用缺氧或社交隔离,在长期用皮质酮处理而,也可以表现出明显的 PPI 缺陷和社交功能障碍。与之相反,野生型小鼠即使长期服用皮质酮,也不能诱发上述障碍。因此,BDNF-e6 缺陷小鼠和皮质酮处理,可以成为一种简化且有效的精分小鼠模型。上述工作证明了疾病模型应该有的第一和第二特征,即比较全面的展示了精分的各类表征,也在一定程度上模拟了精神分裂症的发病机理。
最后,鲁白教授团队还探讨了该模型是否可以用于药效学研究。他们发现模型小鼠注射 TrkB 激活性抗体后,可以激活脑内 BDNF-TrkB 信号通路,并有效地缓解模型小鼠的精分行为,提示 Bdnf 是导致精分的一个相关基因。此外,腹腔注射皮质酮拮抗剂—米非司酮(RU-486),也可翻转 BDNF-e6 缺陷小鼠中由于压力刺激而产生的行为缺陷,提示环境压力刺激通过升高体内皮质酮水平,与 Bdnf 基因缺陷一起诱导精分的发病。未来还需要通过临床试验拓展该模型的第三种特征,即验证在该模型上的药物实验,能够预测在精分病人上的疗效。
这项工作对于精神分裂症的机理研究,临床诊断及相关药物开发,均具有积极意义。首先,这一系列的工作确立了精神分裂症中至少有一个亚型,是由于 BDNF-TrkB 信号通路的缺陷和发育中的环境压力刺激共同造成的,揭示了一种新的发病机制。其次,在临床上可以通过检测血液中 BDNF 表达量的降低或皮质酮含量的升高,来对精神分裂症及其亚型的诊断,提供一个新的思路。基于此,可以开发出一种新型的病人选择策略,更精准更高效地进行临床试验。最后,该工作也为这一类病人提供了增强 TrkB 信号通路和阻断皮质酮升高等两种可能的治疗方案。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


