1月Nature杂志不得不看的重磅级亮点研究!
来源:生物谷原创 2023-01-31 09:32
时间匆匆易逝,转眼间1月份即将结束,在即将过去的1月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
时间匆匆易逝,转眼间1月份即将结束,在即将过去的1月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】Nature:利用FIND-seq成功分离和分析在多发性硬化症中发挥关键作用的星形胶质细胞亚群
Iain C. Clark et al. Identification of astrocyte regulators by nucleic acid cytometry. Nature,2023, doi:10.1038/s41586-022-05613-0.
罕见的细胞类型可能对人类健康产生不适当的影响。以前的研究已表明大脑和脊髓中的星形胶质细胞的一个亚群可能是导致多发性硬化症(MS)的原因。在这种疾病中,免疫系统会攻击保护神经的覆盖层。但要找到这些罕见的细胞并非易事,科学家们需要确定独特的表面标志物,以将这些罪魁祸首细胞与其他细胞区分开来。单细胞RNA测序可以帮助找到它们,即使在没有区分性的表面标志物的情况下,也是如此,但是这种技术可能变得极其昂贵。
为了解决这个问题,在一项新的研究中,来自美国布莱根妇女医院和加州大学旧金山分校等研究机构的研究人员通过结合核酸细胞仪、微流控技术和液滴分选,开发出FIND-se,可根据数字液滴PCR检测的mRNA生物标志物的表达来分离和分析感兴趣的罕见细胞。相关研究结果于2023年1月3日在线发表在Nature期刊上,论文标题为“Identification of astrocyte regulators by nucleic acid cytometry”。

通过使用这种方法,这些作者非常详细地分析了驱动中枢神经系统炎症和神经退化的星形胶质细胞群体。当与其他工具结合使用时,FIND-seq确定了由盐皮质激素受体NR3C2和NCOR2(nuclear receptor corepressor 2)控制的信号通路,这些信号通路在小鼠和人类的致病性星形胶质细胞的产生中起着重要作用。在另一项研究中,他们利用FIND-seq确定了HIV在接受抗逆转录病毒疗法治疗的患者中用来“躲藏”免疫细胞的机制。
【2】Nature:新研究揭示HIV病毒库细胞如何抵抗人类免疫反应的消除
Weiwei Sun et al. Phenotypic signatures of immune selection in HIV-1 reservoir cells. Nature, 2023, doi:10.1038/s41586-022-05538-8.
感染后不久,HIV-1通过在体内形成病毒库(viral reservoir)---感染了HIV但不积极产生新病毒的细胞,从而建立起终身感染。抗逆转录病毒疗法(ART)降低了血液中的HIV水平,但是一小部分感染这种病毒的细胞会无限期地存在,使HIV感染成为一种不治之症。那些能够在停止ART治疗后重新触发感染的细胞极其罕见,而且直到现在还没有被识别和表征。
在一项新的研究中,来自美国国家过敏与传染病研究所、拉根研究所和麻省总医院的研究人员报告了允许对单细胞进行多维表征(单细胞蛋白基因组分析)的新技术的应用,研究了直接从HIV-1感染者身上分离的HIV病毒库细胞。通过这种新的技术方法,他们发现了标志性的表面标志物,这可能解释了一些HIV病毒库细胞如何能够长期存在并抵抗宿主的免疫反应。这一发现可能为未来治愈HIV感染的策略提供参考。相关研究结果于2023年1月4日在线发表在Nature期刊上,论文标题为“Phenotypic signatures of immune selection in HIV-1 reservoir cells”。
研究者Mathias Lichterfeld博士说,“高通量单细胞测序如今使我们能够精确地研究极少数受感染细胞的表面特征,尽管接受了ART治疗,这些细胞仍能终身存在,并且在停止治疗后会促进HIV反弹。有了这些知识,我们就能了解它们的易感性和脆弱性,并能开发出靶向这些细胞的定制免疫反应。”这些作者收集了5名HIV阳性研究参与者的外周血细胞。其中的四名参与者已接受了大约10年的ART治疗,还有1人是尽管没有接受ART治疗但血液中的HIV水平却无法检测出来的“精英控制者(elite controller)”。他们还分析了其中的两名参与者在接受ART治疗仅1-2年后的早期血液样本。他们还收集了三名已接受了10~15年ART治疗的HIV阳性研究参与者的淋巴结细胞。从这些样本中,他们分离出了CD4+记忆T细胞,即在对感染作出反应时产生的白细胞,它们是HIV的主要靶细胞。
这些作者开发了一种新的实验策略,称为表型和前病毒测序(phenotypic and proviral sequencing, PheP-Seq),这是一种单细胞下一代测序技术,用于评估单个病毒感染细胞表面上的生物标志物。利用PheP-Seq,他们分析了53万多个外周血细胞和39.6万个淋巴结细胞。
【3】Nature:新研究揭示HIV感染的CD4 T细胞病毒库的HIV沉默和细胞存活特征
Iain C. Clark et al. HIV silencing and cell survival signatures in infected T cell reservoirs. Nature, 2023, doi:10.1038/s41586-022-05556-6.
了解HIV在抗逆转录病毒疗法(ART)治疗期间如何持续存在,可以推动寻找安全和可扩展的HIV治愈方法。这方面的一个核心例子是潜伏病毒库概念,在潜伏病毒库中,一些HIV前病毒(HIV provirus)被认为是通过保持静止状态,使得携带它们的宿主细胞免于病毒或免疫介导的杀伤而持续存在。支持这一概念的证据包括体外样本中存在罕见的CD4记忆T细胞,这些细胞可诱导性地表达HIV,以及来自培养模型的表明HIV转录遭受分子阻断的数据。这些发现和其他发现促使人们开发能够诱导HIV转录的潜伏期逆转剂(latency-reversing agent, LRA),目的是使得受感染的细胞在体内被消除。
然而,在LRA的临床试验中,没有明显减少HIV病毒库的大小,这强调了在治愈HIV的障碍方面还有很多未知数。特别重要的是,长期以来对HIV感染的CD4 T细胞病毒库的生物学特性并不清楚。由于血液和组织中含有静止病毒的细胞在没有大量操纵的情况下是无法识别的,因此无法确定这些罕见的细胞是否具有有利于HIV潜伏的特殊属性,或以其他方式有助于实现HIV在ART治疗期间的持续存在。试图通过检测HIV在表型、功能或解剖学CD4 T细胞亚群中的富集程度来规避这一障碍的研究在某些情况下使用先进的单细胞分析---发现多种CD4 T细胞亚群的感染细胞水平较低,这就凸显了HIV细胞库的异质性。因此,识别ART治疗期间HIV感染的CD4 T细胞的独特生物特征已成为HIV治愈研究的一个核心挑战。
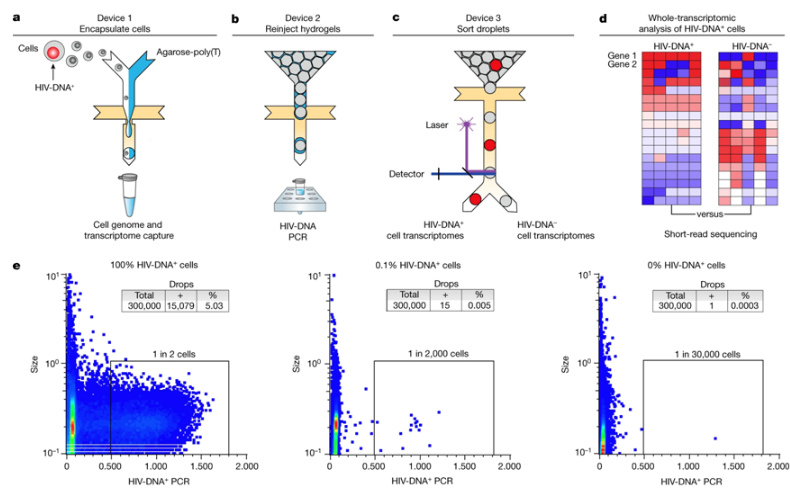
利用FIND-seq对HIV-DNA+ CD4记忆T细胞进行全转录组分析。
图片来源:Nature, 2023, doi:10.1038/s41586-022-05556-6。
为了帮助应对这一挑战,在一项新的研究中,来自美国国家过敏与传染病研究所和加州大学旧金山分校等研究机构的研究人员开发出一种定制的微流控技术,能够直接在体外对HIV感染细胞进行无偏见的检测和基因表达分析。这种技术被称为通过核酸检测和测序对细胞进行聚焦探究(focused interrogation of cells by nucleic acid detection and sequencing, FIND-seq),在油包水液滴中分离出数百万个细胞,以便立即裂解,然后进行聚腺苷化RNA序列回收,再根据HIV DNA检测进行分选。这种方法从含有静止病毒的细胞中分离出整个转录组,不需要体外潜伏期逆转,从而捕捉到这些细胞在自然状态下的全转录组图谱。相关研究结果于2023年1月4日在线发表在Nature期刊上,论文标题为“HIV silencing and cell survival signatures in infected T cell reservoirs”。
【4】Nature:先前感染SARS-CoV-2是否改变人体对其他威胁的免疫反应取决于人体的性别
Rachel Sparks et al. Influenza vaccination reveals sex dimorphic imprints of prior mild COVID-19. Nature, 2023, doi:10.1038/s41586-022-05670-5.
长期以来,感染对免疫系统的长期影响一直吸引着耶鲁大学免疫生物学者John Tsang。在身体面对一种病原体后,免疫系统是否会回到以前的基线?还是说一次感染就改变了它的方式,使它不仅对熟悉的病毒有反应,而且对下一次面临的新病毒或细菌威胁也有反应?Tsang长期以来一直认为,免疫系统在病毒感染后会恢复到之前的稳定基线。2020年COVID-19大流行的出现使得他和同事们能够测试这一理论。根据一项新的研究,他们发现,答案取决于个人的性别。相关研究结果于2023年1月4日在线发表在Nature期刊上,论文标题为“Influenza vaccination reveals sex dimorphic imprints of prior mild COVID-19”。
在这项新的研究中, Tsang和他的同事们系统地分析了接种过流感疫苗的健康人的免疫反应。根据这些数据,他们随后比较了那些从未感染过SARS-CoV-2(导致COVID-19的冠状病毒)的人和那些感染这种病毒后出现过轻微症状但已经康复的人之间的免疫反应。令他们吃惊的是,他们发现从COVID-19轻度病例中康复的男性的免疫系统对流感疫苗的反应比有过轻度病例的女性或从未被感染过的男性和女性更强。他们指出实质上,先前感染SARS-CoV-2的男性的基线免疫状态发生了改变,从而改变了对不同于SARS-CoV-2的暴露的反应。
Tsang说,“这完全出乎意料。女性通常对病原体和疫苗有更强的整体免疫反应,但也更有可能患上自身免疫性疾病。这些发现也可能与大流行病早期的一项观察有关:在感染SARS-CoV-2后,男性比女性更有可能死于失控的免疫反应。这些新的研究结果表明,即使是轻微的COVID-19病例,也可能在男性身上引发比女性更强烈的炎症反应,导致男性免疫系统发生更明显的功能变化,甚至在康复后很久,也是如此。
【5】两篇Nature:科学家发现了一种新的CRISPR-Cas剪刀---CRISPR–Cas12a2
Oleg Dmytrenko et al. Cas12a2 Elicits Abortive Infection via RNA-triggered Destruction of dsDNA. Nature,2023, doi:10.1038/s41586-022-05559-3.
Jack P. K. Bravo et al. RNA Targeting Unleashes Indiscriminate Nuclease Activity of CRISPR-Cas12a2. Nature,2023, doi:10.1038/s41586-022-05560-w.
像人类一样,细菌和古生菌也会受到病毒的攻击。这些微生物已进化出自己的免疫防御策略,以对抗它们的病原体。细菌防御系统,如CRISPR-Cas系统,具有多样化的蛋白和功能,帮助细菌保护自己免受外来入侵者入侵。这种免疫防御基于一个共同的机制:CRISPR核糖核酸(CRISPR ribonucleic acid, crRNA)作为“向导RNA(gRNA)”,帮助检测外来基因组(比如病毒DNA)的区域,以便进行靶向切割。由crRNA指导的CRISPR相关(Cas)核酸酶可以像一把剪刀一样切割它的靶标:这是人类在许多技术中利用的一种自然策略。
来自美国犹他州立大学的生物化学学者Thomson Hallmark和Ryan Jackson与他们的合作者一起,发表了两篇具有开创性的论文。他们的研究结果描述了一种新发现的CRISPR-Cas免疫系统的结构和功能,与更知名的让外来基因灭活来保护细胞的CRISPR-Cas系统不同,这种新的系统关闭受感染的细胞来阻挡感染。相关研究结果于2023年1月4日在线发表在Nature期刊上,论文标题分别为“Cas12a2 elicits abortive infection through RNA-triggered destruction of dsDNA”和“RNA targeting unleashes indiscriminate nuclease activity of CRISPR–Cas12a2”。
Jackson说,“通过这种称为CRISPR-Cas12a2的新系统,我们观察到了它的结构和功能与迄今为止在CRISPR-Cas系统中观察到的结构和功能都不同。”作为第一篇论文第一作者的Oleg Dmytrenko博士说,“我们正在探索最初与Cas12a归类在一起的CRISPR核酸酶,这类核酸酶通过识别和切割侵入性DNA来保护细菌。一旦我们发现了更多的它们,我们就意识到它们与Cas12a有足够的不同,可以进行更深入的研究。这种探索使我们发现这些我们称之为Cas12a2的核酸酶,它们不仅与Cas12a有很大的不同,而且与任何其他已知的CRISPR核酸酶也有很大的不同。”
【6】Nature:通过构建含有20多万张细胞图像的数据库,发现形状相似的细胞具有类似的内部组织
Matheus P. Viana et al. Integrated intracellular organization and its variations in human iPS cells. Nature,2023, doi:10.1038/s41586-022-05563-7.
在一项新的研究中,来自美国艾伦细胞科学研究所(Allen Institute for Cell Science)的研究人员通过处理数十万张高分辨率图像,对人类细胞的内部组织(internal organization)---一种迄今为止被证明非常难以定量确定的生物学概念---进行了统计。他们还捕捉到了关于细胞形状丰富变化的细节,即使是在相同条件下生长的基因完全一致的细胞。相关研究结果于2023年1月4日在线发表在Nature期刊上,论文标题为“Integrated intracellular organization and its variations in human iPS cells”。
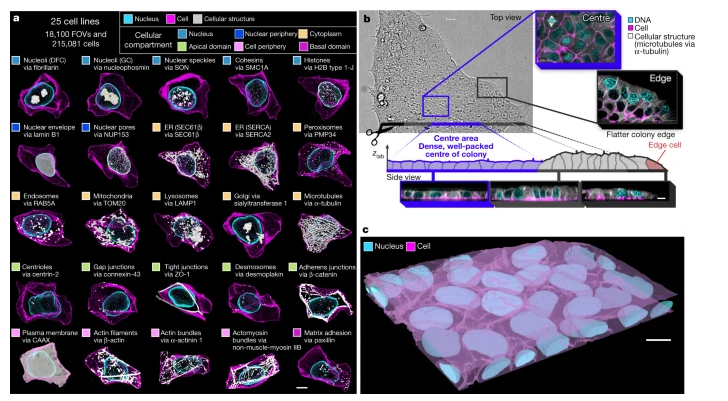
WTC-11 hiPSC单细胞图像数据集v1包括25种代表位于细胞所有主要区室的关键细胞结构的细胞系。
图片来源:Nature, 2023, doi:10.1038/s41586-022-05563-7。
研究者Susanne Rafelski博士说,“细胞的组织方式告诉我们一些关于它们的行为和身份的信息。当我们都试图了解细胞在健康和疾病中如何变化时,这个领域一直缺少的是处理这种细胞内部组织的严格方法。我们还没有挖掘出这种信息。”Rafelski说,这项新的研究为生物学家们提供了一个路线图,以一种可测量的、定量的方式了解不同类型的细胞的内部组织。它还揭示了这些作者研究的称为人类诱导性多能干细胞(human induced pluripotent stem cell, iPS细胞)的细胞的一些关键组织原则。
了解细胞在健康条件下如何组织自己---以及“正常”状态下所包含的全部变化---可以帮助科学家们更好地了解疾病中的问题所在。这项新研究中的图像数据集、经过基因改造的干细胞和代码都是公开的,供科学界中的其他科学家使用。加州大学旧金山分校生物化学与生物物理学教授、艾伦细胞科学研究所科学顾问委员会成员Wallace Marshall博士说,“使得细胞生物学看起来难以解决的部分原因是,每个细胞看起来都不一样,即使它们是同一类型的细胞。这项新的研究表明,这种长期困扰该领域的可变性实际上是研究细胞内部组成规则的一个机会。这种方法几乎可以推广到任何细胞,我期望其他许多人也能采用同样的方法。”
【7】Nature:构建出在人类细胞中发现的300多种蛋白激酶的综合图谱
Jared L. Johnson et al. An atlas of substrate specificities for the human serine/threonine kinome. Nature,2023, doi:10.1038/s41586-022-05575-3.
人类最重要的酶之一是蛋白激酶,它们是调节几乎所有细胞活动(包括生长、细胞分裂和代谢)的信号分子。这些细胞途径的功能失调可导致多种疾病,特别是癌症。识别参与细胞功能障碍和癌症发展的蛋白激酶可以产生许多新的药物靶标,但是对于这些激酶中的绝大多数,科学家们并没有清楚地了解它们参与了哪些细胞途径,或者它们的底物是什么。
美国麻省理工学院精准癌症医学中心主任Michael Yaffe教授说,“我们有大量的癌症基因组测序数据,但我们缺少的是对癌症中信号通路和蛋白激酶激活状态的大规模研究。如果我们有这些信息,我们就会对如何治疗特定的肿瘤有更好的想法。”在一项新的研究中,Yaffe、耶鲁大学医学院的Benjamin E. Turk博士和威尔康乃尔医学院的Lewis C. Cantley博士及其同事们构建出一个包含在人类细胞中发现的300多种蛋白激酶的综合图谱,并确定了它们可能靶向和控制哪些蛋白。这些信息可能帮助科学家们破译许多细胞信号通路,并帮助他们发现当细胞发送癌变或用特定药物治疗时,这些信号通路会发生什么变化。相关研究结果于2023年1月11日在线发表在Nature期刊上,论文标题为“An atlas of substrate specificities for the human serine/threonine kinome”。
人类基因组包括500多种蛋白激酶,它们通过给其他蛋白标记上称为磷酸基团的化学修饰来激活或失活这些蛋白。对于这些激酶中的大多数,它们所靶向的蛋白是未知的,尽管对MEK和RAF等激酶的研究已导致了抑制这些激酶的新癌症药物,其中MEK和RAF这两种激酶都参与了控制生长的细胞途径。为了确定癌细胞中失调的其他途径,这些作者依靠使用质谱的磷酸化蛋白质组学(phosphoproteomics)来发现癌细胞或健康细胞中磷酸化程度较高的蛋白。然而,在此之前,还没有一种简单的方法来研究质谱数据,以确定哪些蛋白激酶负责磷酸化这些蛋白。正因为如此,这些蛋白在疾病中是如何受到调控或遭受异常调控的仍是未知的。
【8】Nature:科学家使用铁磁机器人实现灵活高效的自动化病毒检测
Haisong Lin,Wenzhuo Yu,Kiarash A Sabet,et al. Ferrobotic swarms enable accessible and adaptable automated viral testing,Nature.2022 Nov;611(7936):570-577. doi:10.1038/s41586-022-05408-3
在全球范围内提高病毒诊断和监测检测能力是流行病预防的关键。核酸扩增检测(NAATs)相比抗原抗体检测具有更优的灵敏度、特异性和快速部署能力。然而,当前基于 NAAT 的自动化检测平台无法灵活实现集成的液体处理、分析和自动反馈流程,并且它们的设备笨重、昂贵、试剂损耗大,需要繁琐的安装和维护要求,因此限制了其检测能力。近日,来自加州大学洛杉矶分校(UCLA)的研究团队在《Nature》期刊上发表题为“Ferrobotic swarms enable accessible and adaptable automated viral testing”的文章。该研究开发了一种基于NAAT的自动化检测平台,可以在灵活的工作流程中以并行方式执行可编程的液体处理和生物分析操作。
该平台使用一群毫米级大小的磁铁作为执行机器人(“铁磁机器人”),它们可以精确操控磁性样品液滴,并在核酸扩增检测的基础上高保真地提供灵活的工作流程。该平台将流体设备、硬件和软件集成在一块手掌大小的印刷电路基板(PCB)上,可同时对16个样本进行检测。通过对PCB进行编程后能够以全自动化的方式完成包括样本输运、分液、混合、逆转录循环介导等温扩增(RT-LAMP)和比色法光电检测在内的全部流程。此外,为了最大限度地提高筛查效率,研究人员建立了基于患病率的自适应检测算法。
该算法可以确定最佳的检测模式,并根据方形矩阵集合方案操作检测流程,避免了过于繁琐的样本处理程序。随后,研究人员使用病毒样本对该平台的检测性能进行测试,并与RT-PCR检测(金标准)进行比较,结果显示该平台的检测灵敏度为98%,特异性为100%。
【9】Nature:科学家绘制出灵长类胚胎原肠运动至早期器官发育转录组图谱
Jinglei Zhai,Jing Guo,Haifeng Wan,et al. Primate gastrulation and early organogenesis at single-cell resolution,Nature.2022 Dec;612(7941):732-738. doi:10.1038/s41586-022-05526-y
人的生命始于精子与卵子融合形成受精卵(胚胎期第0天;Embryonic day 0;E0),受精卵经历卵裂形成囊胚,囊胚在E7左右种植到母体子宫进一步发育。E14开始,胚胎经历原肠运动,胚胎后部细胞发生大规模定向迁移,并形成原条细胞。原条细胞进一步分化为中胚层和定型内胚层(definitive endoderm),同时胚胎前部细胞分化为外胚层。基于此,胚胎发育成为具有内胚层、中胚层和外胚层的三胚层胚胎。经过复杂的信号通路调控,三胚层胚胎进一步形成各种器官原基,并最终形成我们身体中包括神经系统、消化系统、呼吸系统、心血管循环系统、泌尿生殖系统等所有系统的各种器官。原肠运动和三胚层分化异常与多种出生缺陷(如先天性心脏病和神经管畸形等)和发育源性疾病相关。探索人类早期胚胎发育过程及机制对于这些疾病的诊断和治疗至关重要。
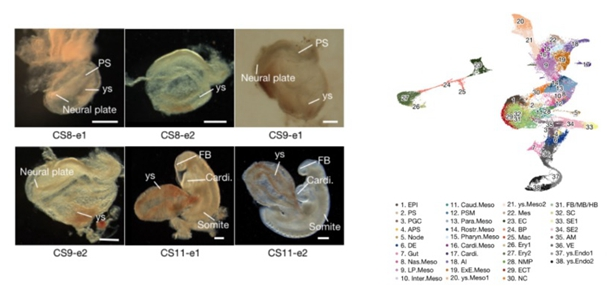
CS8-CS11时期食蟹猴胚胎的明场图(左)与38种主要细胞类群(右)
图片来源:Nature.2022 Dec;612(7941):732-738. doi:10.1038/s41586-022-05526-y
中国科学院动物研究所王红梅和郭帆团队、美国德克萨斯大学西南医学中心吴军团队以及安徽医科大学蒋祥祥团队合作在Nature杂志上发表了题为Primate gastrulation and early organogenesis at single-cell resolution的研究论文。该研究以食蟹猴为模型,利用单细胞转录组测序和干细胞分化模型等,绘制了食蟹猴CS8-CS11时期(E20-E29)胚胎的单细胞转录组图谱,揭示了原肠运动和三胚层分化(神经管、体节、肠管等的发育)过程中重要细胞类群的特征及其谱系发生和调控机制,并比较了啮齿类和灵长类早期胚胎发育事件的进化差异。
研究收集了CS8-CS11阶段的食蟹猴胚胎,利用10X单细胞转录组测序技术捕获了56636个单细胞并进行生物信息学分析,明确定义了食蟹猴该时期的38个主要细胞类群,绘制了目前国际上第一张灵长类CS8-CS11胚胎的高通量单细胞转录组图谱。
【10】Nature:新冠会改变免疫系统 或会导致机体过度的免疫反应
Rachel Sparks, William W Lau, Can Liu, et al. Influenza vaccination reveals sex dimorphic imprints of prior mild COVID-19, Nature.2023 Jan 4. doi:10.1038/s41586-022-05670-5
新冠病毒,通常通过呼吸道感染人类,并造成呼吸系统和人体各个器官的损伤。自2019年底首次爆发至今,新型冠状病毒仍在全球肆虐,对世界经济、社会造成极大的负面影响。众所周知,急性病毒感染在康复后很长一段时间内会对免疫系统产生持久的功能影响,感染新冠后,免疫系统会恢复到之前的状态吗?感染后是否会改变免疫系统面对其他病毒的反应方式?
近日,一篇发表在国际杂志Nature上题为“Influenza vaccination reveals sex dimorphic imprints of prior mild COVID-19”的研究报告中,来自美国国家过敏和传染病研究所等机构的科学家们通过研究发现,感染新冠后,即使是轻症,也会改变男性的免疫状态,使男性对流感疫苗的反应更强烈,表明感染后,在面对其他病毒时,男性会引发更强烈的炎症反应,导致男性免疫系统发生更明显的功能变化,即使在康复后很长时间也是如此。
在该研究中,研究人员使用系统免疫学方法,通过接种流感疫苗,系统性分析了未感染新冠的人和轻症新冠但已康复的人之间的免疫状态以及对接种流感疫苗反应;总的来说,感染新冠后,康复者的T细胞激活特征升高,单核细胞中先天免疫基因的表达降低。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


