2024上半年,10家制药巨头放弃开发80个项目……
来源:医药魔方 2024-08-24 09:29
10家MNC在2024上半年已从更新的管线中移除了80余个项目。从疾病领域来看,肿瘤占比将近一半。
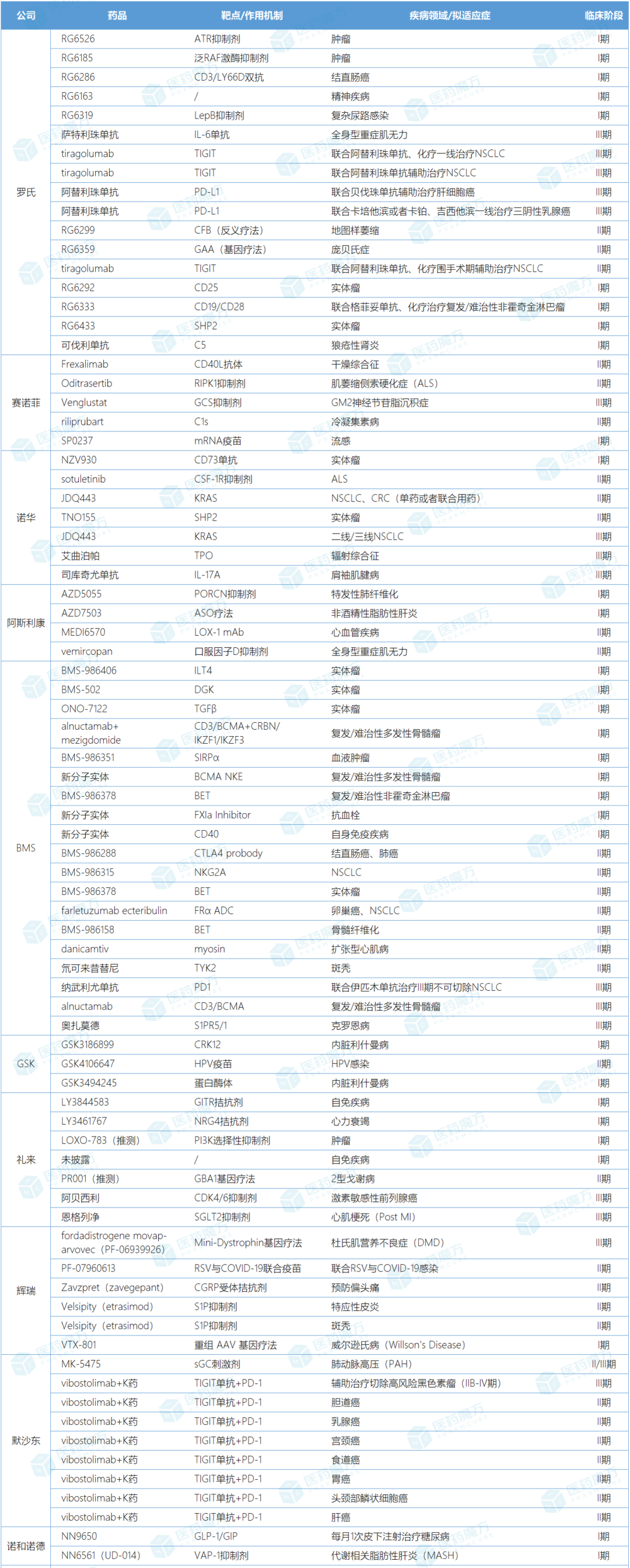
注:数据来自各企业财报及更新的管线信息

罗氏持续优化管线,自2023年第二季度以来已经终止了25%的新分子实体药物(NME)。在2024上半年,罗氏共从管线中剔除了17个临床研究项目(9个NMEs,8项新适应症),肿瘤领域占比超过6成,其中不乏CD19/CD28双抗和SHP2抑制剂等NMEs的早期临床研究被终止开发,也有阿替利珠单抗等已上市药物扩展新适应症进展不顺的III期临床被砍掉。
罗氏终止了阿替利珠单抗联合贝伐珠单抗(“T+A”)辅助治疗肝癌的一项III期临床研究。此前,“T+A” 疗法在肝癌辅助治疗中已有IMbrave050和TALENTop两项III期研究取得积极结果。
阿替利珠单抗在三阴乳腺癌(TNBC)的探索也可谓“一波三折”。该药联合卡培他滨/卡铂或吉西他滨一线治疗TNBC的III期IMpassion132研究并未取得阳性结果,就此落幕。不过一次失败并不能阻挡阿替利珠单抗扩大适应症的脚步,罗氏仍在尝试其在其他肿瘤的应用,相关4项III期临床试验正在进行当中。
罗氏还终止了免疫检查点TIGIT抑制剂G6058(tiragolumab)的两项III期临床研究,一项是tiragolumab联合阿替利珠单抗+化疗一线治疗NSCLC,另一项是tiragolumab联合阿替利珠单抗辅助治疗NSCLC。但罗氏并未放弃tiragolumab的开发,相关的8项临床研究正在进行当中。这个靶点暂未有新药上市,全球有超80个TIGIT在研项目,除罗氏外,默沙东、AZ、GSK、吉利德等多家制药巨头均有布局。
此外,罗氏放弃了9个NMEs的开发,包括:小分子共济失调-毛细血管扩张症和Rad3相关蛋白激酶(ATR)抑制剂RG6526(Camonsertib)、口服泛RAF激酶抑制剂RG6185(Belvarafenib)、CD3/LY66D双抗RG6286、神经科学领域的候选药物RG6163、、CD25单抗RG6292(vopikitug)、CD19/CD28双抗RG6333、SHP2变构抑制剂RG6433(migoprotafib)、庞贝病基因疗法RG6359(SPK-3006)和LepB抑制剂RG6319。这些NMEs大部分都处于I期临床阶段,其中4个是罗氏从其他公司引进的产品。LepB抑制剂(原RG6319)将使用RG6436继续进行有关复杂尿路感染的I期临床研究。

2024上半年,赛诺菲终止开发5个临床研究项目,包括:mRNA疫苗SP0273一项I期临床研究、CD40L抗体frexalimab一项II期临床研究、RIPK1抑制剂oditrasertib(DNL788)的II期HIMALAYA研究、GCS抑制剂venglustat的III期AMETHIST研究、C1s单抗riliprubart一项III期研究。
Frexalimab是赛诺菲2017年从ImmuNext引进的自免疾病药物,其在干燥综合征的II期临床研究中虽然显示出良好的药理活性和安全性,但并未展示出很好的疗效结果,所以该研究被终止。该药治疗复发型多发性硬化症(RMS)和继发进展型多发性硬化症(SPMS)的III期研究、治疗1型糖尿病和系统性红斑狼疮的II期临床研究将会继续进行。
由于venglustat治疗GM2神经节脂质沉积症的III期AMETHIST研究缺乏达到临床终点的积极趋势,赛诺菲也将venglustat针对这一适应症的开发画上了终止符。不过venglustat其他正在开发的适应症不受影响。
Venglustat是Paul Hudson在2019年接任赛诺菲CEO时确定的最具前景的资产之一。然而该款药物却一直带来研发失利的消息,2021年赛诺菲停止了其用于治疗常染色体显性多囊肾病的II/III期试验。venglustat治疗帕金森病的II期研究也未达主要终点,此次GM2神经节脂质沉积症适应症被消除后,venglustat还在开发的适应症仅剩下III型戈谢病和法布瑞氏症。
DNL788是赛诺菲2018年从Denali Therapeutics 引进的神经系统治疗药物,有望应用于阿尔茨海默病(AD)、肌萎缩侧索硬化症(ALS)和多发性硬化症(MS)。今年2月份,该药治疗ALS的II期HIMALAYA研究未达到主要终点,赛诺菲将继续其在MS方面的II期临床研究。
出于优先考虑其他项目的原因,赛诺菲将不会推进riliprubart治疗罕见病—冷凝集素病中的III期研究。另外,赛诺菲将处于I期临床阶段的mRNA流感疫苗SP0273从管线中移除,目前其在研的I期临床阶段的mRNA疫苗有:流感疫苗SP0237、呼吸道合胞病毒(RSV)疫苗SP0256、痤疮疫苗SP0268。

诺华在2024上半年终止了7个临床研究项目,包括:KRAS G12C抑制剂JDQ443(opnurasib)一项II期和一项III期临床研究、司库奇尤单抗扩展适应症的肩袖肌腱病III期临床研究、TPO受体激动剂艾曲泊帕扩展适应症的III期临床研究、SHP2变构抑制剂TNO155(batoprotafib)一项II期临床研究、CSF-1R抑制剂sotuletinib一项II期临床研究、CD73单抗NZV930一项I期临床研究。其中候选药物JDQ443、TNO155、sotuletinib、NZV930已被诺华从管线中移除。
包括TNO155在内,诺华曾拥有5个SHP2小分子抑制剂,但SHP099、SHP244、SHP389和SHP394都止步于临床前研究。随着这次TNO155的II期临床终止,诺华恐怕要暂缓这一靶点的开发。首个开启临床研究的SHP2抑制剂TNO155也未能打破该靶点“不可成药”的魔咒,让人疑问SHP2是否能迎来真正成功的上市药物。加科思今年启动III期临床的JAB-3312成为了下一阶段的领跑者,相信时间会给出答案。
KRAS G12C是肿瘤领域又一热门靶点,首个抑制剂来自安进2021年上市的sotorasib,2023年其销售额达2.8亿美元;另一款获批上市的产品是BMS的adagrasib。除诺华外,罗氏、默沙东、礼来等MNC纷纷投身于这一赛道,而国内企业的竞争也不可谓不激烈,信达、正大天晴、加科思已向CDE递交了上市许可申请,翰森、贝达和恒瑞也开展了临床研究。然而,根据诺华Q2财报,JDQ443的NSCLC III期临床研究因优先考虑其他关键项目而终止,其更新的管线中已没有KRAS产品,诺华在这一靶点的研究也告一段落。

上半年,阿斯利康终止了4个临床研究项目(3个NMEs和1项新适应症)。3个NME包括:PORCN抑制剂AZD5055、反义寡核苷酸药物(ASO)AZD7503和LOX-1单抗MEDI6570。另外该公司还终止了口服因子D抑制剂ALXN2050(vemircopan)的一项II期临床研究。这些分子都处于早期研发阶段。
AZD5055是一款PORCN抑制剂,2020年阿斯利康以1700万美元首付款和3.6亿美元的潜在里程碑付款从Redx Pharma引进该项目。Q1财报显示,基于战略投资组合的优先次序考虑,阿斯利康终止了AZD5055治疗特发性肺纤维化的I期临床研究。
AZD7503是阿斯利康从Ionis引进的一款ASO疗法,旨在抑制17β-羟基类固醇脱氢酶13(HSD17B13)蛋白的产生,曾于2021年首次进入I期临床,被开发用于治疗MASH,同样基于战略投资组合的优先次序考虑,阿斯利康停止了AZD7503的3项I期临床研究。MEDI6570是一款靶向LOX-1的单抗,曾被开发用于治疗心肌梗塞、心衰等心血管疾病,不过也因战略考虑而止步于II期临床。
罕见病候选药vemircopan治疗全身型重症肌无力的II期临床研究因缺乏疗效而终止。阿斯利康将会继续推进vermicopan治疗增生型狼疮肾炎和IgA肾病的II期临床研究,以及vermicopan治疗肝功能受损的的I期临床研究。

BMS在2024上半年对产品管线做出了果断调整,共终止19个临床研究项目,其中7成是肿瘤领域研究。BMS表示管线合理化可以节约成本,再去重点投资高潜力项目,有助于公司转型并推动长期增长。
肿瘤领域,BMS终止了10款早期研发阶段候选药物的临床研究,包括:CTLA4 probody(前抗体药物)BMS-986288、NKG2A单抗BMS-986315、ILT4单抗BMS-986406、DGK抑制剂BMS-502、TGFβ抑制剂ONO-7122、BET抑制剂 BMS-986378和BMS-986158、FRα ADC药物farletuzumab ecteribulin(引进自卫材,现已终止合作)、SIRPα单抗BMS-986351、BCMA NKE。
今年5月,BMS宣布纳武利尤单抗联合伊匹木单抗(PD-1+CTLA4)治疗局部晚期III期不可切除NSCLC的III期CheckMate-73L研究(NCT04026412)未达主要终点。对比对照组度伐利尤单抗的PACIFIC模式,遗憾的是,纳武利尤单抗+同步放化疗未改善患者的PFS。BMSQ2更新的管线显示,纳武利尤单抗还有4项III期临床研究正在进行当中。

血液肿瘤领域,BMS终止了CD3/BCMA双抗alnuctamab单药治疗复发/难治性多发性骨髓瘤(MM)的III期临床研究及alnuctamab联合分子胶降解剂mezigdomide用于相同适应症的II期临床研究。Mezigdomide仍有两项MM的III期临床正在进行中。Alnuctamab目前则被BMS从管线中移除。另外还有两个处于I期临床阶段的自免候选药物(CD40单抗、未披露的NME)被终止开发。
自免领域,S1PR1/R5调节剂奥扎莫德针对中度至重度克罗恩病(CD)患者开展的III期YELLOWSTONE研究未达到主要终点,就此宣告失败。无独有偶,据医药魔方数据库显示,同样治疗自免疾病的TYK2抑制剂氘可来昔替尼针对斑秃的一项II期临床研究也在今年5月终止。不过BMS正在探索氘可来昔替尼在银屑病关节炎(PsA)、干燥综合征和系统性红斑狼疮(SLE)中的应用,相应的3项III期临床研究正在进行当中,以寻求该药物在已获批的银屑病基础之上继续扩大适应症。
除了肿瘤和自免领域,BMS上半年还终止了心血管疾病候选药物FXIa抑制剂的I期临床研究和myosin激活剂danicamtiv的II期临床研究。

GSK在上半年放弃了3项处于早期研发阶段候选药物的临床研究,分别是CRK12抑制剂GSK3186899和蛋白酶体抑制剂GSK3494245治疗内脏利什曼病的I期临床研究,及HPV疫苗GSK4106647的II期临床研究。

礼来在上半年里共移除了7项临床研究,包括:GITR拮抗剂LY3844583治疗自免疾病、NRG4拮抗剂LY3461767治疗心衰、PI3K选择性抑制剂LOXO-783治疗肿瘤和另一个未披露分子用于自免的I期临床研究;GBA1基因疗法PR001治疗2型戈谢病的I/II期临床研究;CDK4/6抑制剂阿贝西利治疗激素敏感性前列腺癌的III期研究及SGLT2抑制剂恩格列净治疗心肌梗死(Post MI)的III期研究。
礼来2020年以8.8亿美元收购了Prevail Therapeutics,收获了神经退行性疾病AAV9基因疗法,其中包括潜在first-in-class GBA1基因疗法LY3884961(PR001)。今年礼来终止了PR001治疗婴儿2型戈谢病的I/II期临床研究(NCT04411654),另外两项治疗戈谢病(NCT05487599)和帕金森(NCT04127578)的I/II期研究将继续进行,预计在2030年左右完成。同样处于早期研发阶段的LOXO-783是礼来自主开发的高选择性PI3Kα H1047X变构抑制剂。该药在乳腺癌/其他实体瘤中的I期PIKASSO-01研究(NCT05307705)也被终止。
CDK4/6抑制剂阿贝西利联合醋酸阿比特龙+泼尼松一线治疗转移性去势抵抗前列腺癌(mCRPC)的III期CYCLONE-2研究(NCT03706365)未达到放射学无进展生存期(rPFS)的主要终点,在研究次要终点OS方面也没有显著改善,礼来将该研究从管线中移除。阿贝西利还有两项乳腺癌III期临床研究(NCT03155997、NCT05169567)正在开展。

辉瑞上半年终止了8个临床研究项目,包括基因疗法fordadistrogene movaparvovec(PF-06939926)两项杜氏肌营养不良症(DMD)临床研究、RSV与COVID-19联合疫苗PF-07960613的II期临床研究、CGRP受体拮抗剂Zavzpret(zavegepant)预防偏头痛的II期临床研究、S1P抑制剂Velsipity(etrasimod,伊曲莫德)两项II期临床研究和重组AAV基因疗法VTX-801治疗威尔逊氏病(Willson's Disease)的I期研究。
由于DMD基因疗法fordadistrogene movaparvovec的III期CIFFREO研究并未达到主要终点,辉瑞将终止开发该产品。虽然fordadistrogene movaparvovec在开发过程中遭遇了挫折,但辉瑞另外两款血友病基因疗法giroctocogene fitelparvovec和fidanacogene elaparvovec的进展则显得相对顺畅。giroctocogene fitelparvovec治疗血友病A的III期研究成功,fidanacogene elaparvovec今年7月获欧盟委员会有条件上市许可,用于治疗血友病B。
Velsipity是一款选择性鞘氨醇-1-磷酸(S1P)受体调节剂,与S1P受体1、4和5结合,由Arena Pharmaceuticals公司开发,辉瑞2022年完成了对Arena的收购,云顶新耀拥有该药在大中华区和韩国开发、生产和商业化的独家权利。Velsipity已被批准用于溃疡性结肠炎(UC),辉瑞在今年上半年终止了该药物治疗特应性皮炎和斑秃的两个II期临床研究。但Velsipity在克罗恩病(CD)和嗜酸细胞性食管炎(EE)方面的II期临床研究将不受影响,辉瑞会继续为其拓展自免领域新适应症。Zavzpret是辉瑞2023年上市的偏头痛鼻喷雾剂,其口服剂型预防偏头痛的II期临床研究被终止,这预示着辉瑞将暂缓口服Zavzpret的开发。

2024上半年,默沙东终止了9个临床研究项目,主要是TIGIT单抗vibostolimab+帕博利珠单抗组合(MK-7684A)在临床开发计划上有所调整。对比财报中的信息,MK-7684A 在III期临床中移除了黑色素瘤相关研究,保留了两项NSCLC和SCLC相关III期临床研究;II期临床中移除了胆道癌、乳腺癌、宫颈癌、食道癌、胃癌、肝癌和头颈部鳞状细胞癌相关7项研究,保留了膀胱癌、结直肠癌、子宫内膜、卵巢癌、前列腺癌和结直肠癌相关6项II期临床研究。
默沙东在代谢疾病领域的下一代重要候选药物—MK-5475(sGC刺激剂)吸入粉雾剂治疗肺动脉高压(PAH)的II/III期临床研究(NCT04732221)也在更新的管线列表中被移除。该研究已完成,但是具体的结果尚未披露。默沙东已开启了MK-5475针对慢性阻塞性肺疾病相关肺动脉高压(PH-COPD)患者的II期临床研究(NCT05612035)。

2024上半年,诺和诺德终止了两个临床研究项目。首先是每月1次的皮下注射GLP-1/GIP双受体激动剂,其治疗糖尿病I期临床研究已被终止。不过,在GLP-1/GIP的布局上,诺和诺德还有每周1次的候选药物在继续推进。在Q1财报中,诺和诺德表示已启动每周1次的GLP-1/GIP项目的II期糖尿病临床研究。
另外一个候选药是VAP-1抑制剂NN6561,诺和诺德出于产品组合的考虑停止了该药正在进行的代谢相关脂肪性肝炎(MASH)相关I期临床研究,并不再进一步开发。
总结
上述10家MNC在2024上半年已从更新的管线中移除了80余个项目。从疾病领域来看,肿瘤占比将近一半。靶点方面,并没有明显的集中趋势,只有TIGIT、PD-(L)1、SHP2这3个靶点被两家MNC同时优化调整。
已上市的PD-(L)1药物中,罗氏终止了阿替利珠单抗两项III期临床研究(“T+A”辅助治疗肝癌、联合卡培他滨/卡铂或吉西他滨一线治疗TNBC),BMS终止了纳武利尤单抗一项III期临床研究(联合伊匹木单抗治疗局部晚期III期不可切除NSCLC)。
罗氏和默沙东在TIGIT抑制剂的开发中均采用免疫联合策略,共削减了3项III期临床研究和8项II期临床研究。诺华和罗氏的SHP2变构抑制剂(TNO155和RG6433),分别处于II期临床和I期临床阶段,在更新的管线中,都已经不见踪影。
以上10家MNC终止的研发项目中,I期和II期临床项目占比75%。新药研发中,尽管早期的尝试可能遭遇失败,但这些对未知领域的勇敢探索会成为通往成功之路的坚定基石,最终为患者带来福音。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


