首个CRISPR基因编辑疗法!美国FDA授予exa-cel(CTX001)滚动审查!
来源:生物谷原创 2022-09-29 02:09
exa-cel有潜力成为全球首个获得监管批准的CRISPR基因编辑疗法,这是一种自体、体外CRISPR/Cas9基因编辑疗法,目前正被开发作为镰状细胞病(SCD)和输血依赖型β地中海贫血(TDT)。
CRISPR-Cas9基因编辑(图片来源:CRISPR Therapeutics)
2022年09月28日讯 /生物谷BIOON/ --Vertex制药公司与合作伙伴基因编辑公司CRISPR Therapeutics近日联合宣布,Vertex已结束与美国食品和药物管理局(FDA)的讨论,FDA授予了exagamglogene autotemcel(exa-cel,前称CTX001)滚动审查:这是一种自体、体外CRISPR/Cas9基因编辑疗法,用于治疗镰状细胞病(SCD)和输血依赖型β地中海贫血(TDT)。Vertex将于2022年11月开始提交生物制品许可申请(BLA),以供滚动审查,并预计将于2023年第一季度完成提交。Vertex之前已经与欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)就支持exa-cel上市申请所需的数据进行了讨论,并有望在2022年底前提交。
exa-cel是一种在研的、自体、体外CRISPR/Cas9基因编辑疗法,目前正被开发作为SCD和TDT的一次性疗法(one-time therapy)。在这种疗法中,患者的造血干细胞被改造成在红血球中产生高水平的胎儿血红蛋白(HbF;血红蛋白F)。HbF是一种携带氧气的血红蛋白,在出生时自然存在,然后转换为成人形式的血红蛋白。exa-cel升高HbF有潜力减轻TDT患者的输血需求、减少SCD患者痛苦且使人虚弱的镰状细胞危象。
exa-cel有潜力成为全球首个获得监管批准的CRISPR基因编辑疗法,改变SCD和TDT患者的生活。exa-cel是根据CRISPR Therapeutics和Vertex之间的共同开发和共同商业化协议进行开发,根据该项目迄今为止的进展,exa-cel已被授予了多项重要的监管资格,包括:在美国已被授予了治疗SCD和TDE的再生医学先进疗法(RMAT)、快速通道资格(FTD)、孤儿药资格(ODD)、罕见儿科疾病资格(RPDD),在欧盟被授予了治疗SCD和TDT的优先药物资格(PRIME)和孤儿药资格(ODD)。
exa-cel是治疗SCD和TDT方面临床推进最快的基因编辑方法,同时也是第一个在临床上已被证明概念正确的CRISPR/Cas9治疗方法。已获得的临床试验数据显示,接受单次输注exa-cel的重度SCD患者,快速实现了强劲、持久、泛细胞HbF高水平表达,同时减少了痛苦和使人衰弱的镰状危象。此外,接受单次输注exa-cel的TDT患者,快速实现了强劲、持久、泛细胞HbF高水平表达,同时减轻了输血需求。
exa-cel临床试验的早期结果于2021年1月发表在《新英格兰医学杂志》,最新结果于2022年6月在欧洲血液学协会(EHA)年会上公布(详见:Efficacy and Safety of a Single Dose of CTX001 For Transfusion-Dependent Beta-Thalassemia and Severe Sickle Cell Disease)
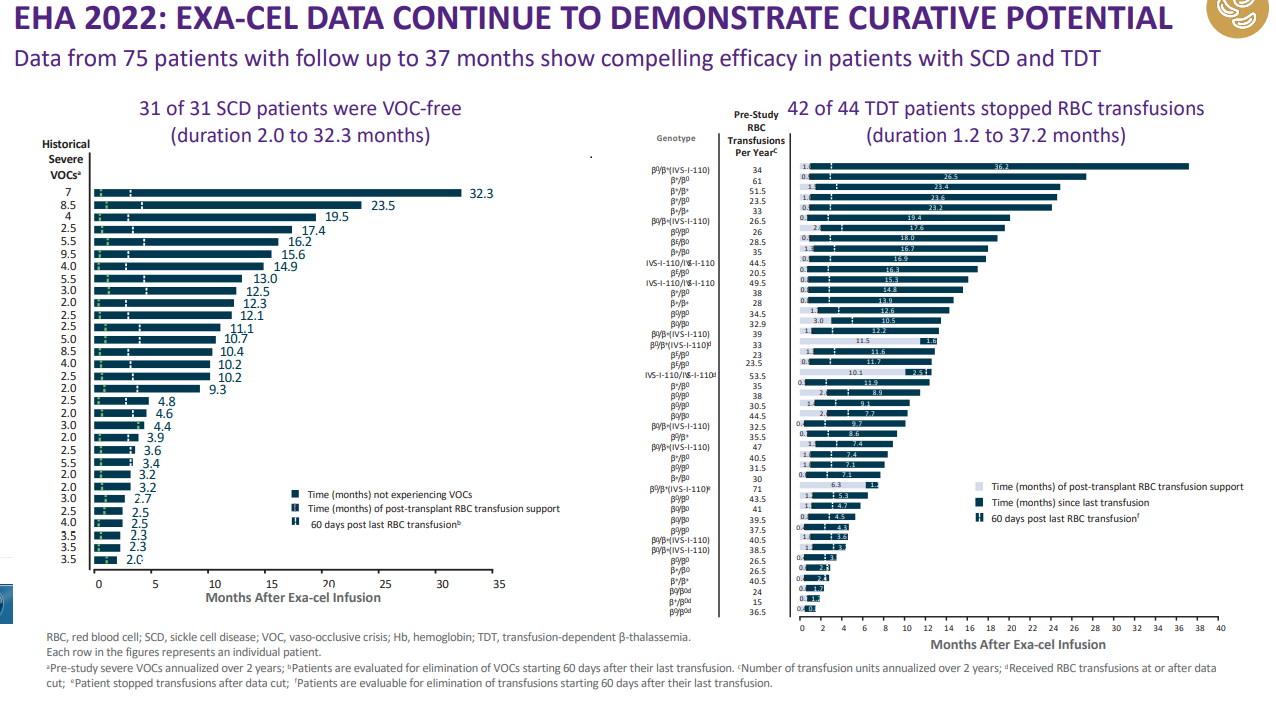
exa-cel项目最新临床数据(来源于:EHA2022年会,点击图片查看大图)
exa-cel的临床开发项目包括多项临床试验:(1)正在进行的1/2/3期开放标签试验CLIMB-111和CLIMB-121,旨在分别评估单剂量exa-cel在12-35岁TDT患者和SCD患者中的安全性和有效性。这2项试验已结束患者入组,在exa-cel输注后,将对患者进行大约2年的随访。(2)正在进行的3期开放标签试验CLIMB-141和CLIMB-151,旨在分别评估单剂量exa-cel在2-11岁TDT患者和SCD患者中的安全性和有效性。这2项试验已开放患者入组,在exa-cel输注后,将对患者进行大约2年的随访。(3)CLIMB-111、CLIMB-121、CLIMB-141、CLIMB-151试验中的每例患者,都将被要求参与CLIMB-131长期随访试验,这项试验旨在对患者接受exa-cel输注后进行长达15年的随访。
CRISPR Therapeutics与Vertex于2015年达成了一项战略研究合作,重点是利用CRISPR/Cas9发现和开发针对人类疾病内在遗传原因的潜在新疗法。exa-cel是联合研究计划中出现的第一种治疗方法。2021年4月,Vertex与CRISPR Therapeutics宣布修订合作协议。根据修订后的协议,Vertex将领导exa-cel(CTX001)的全球开发、制造和商业化;双方在研发成本和利润的分配比例,将由之前的5:5修订为Vertex占60%、CRISPR占40%。此外,CRISPR将收到9亿美元的预付款,在exa-cel获得监管部门批准后,还将收到2亿美元的里程碑付款。
Vertex将部署其在制造、开发、监管和商业化方面的广泛全球能力和成熟经验,以最大限度地发挥exa-cel改变美国、欧洲和其他国家成千上万患者生活的潜力。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


