Nature Medicine:抗癌战场迎来"智能导弹"!B7H3靶向药物改写晚期实体瘤治疗困局
来源:生物探索 2025-03-16 15:08
全球首个B7H3靶向抗体偶联药物YL201,在312名经多线治疗失败的晚期实体瘤患者中,竟让63.9%的小细胞肺癌、48.6%的鼻咽癌患者肿瘤显著缩小!
《Nature Medicine》揭晓的这项突破性临床研究“A B7H3-targeting antibody–drug conjugate in advanced solid tumors: a phase 1/1b trial”,给出了震撼答案——全球首个B7H3靶向抗体偶联药物YL201,在312名经多线治疗失败的晚期实体瘤患者中,竟让63.9%的小细胞肺癌、48.6%的鼻咽癌患者肿瘤显著缩小!更令人惊叹的是,这款"生物导弹"以独特的双效释放机制,将3级以上间质性肺病发生率压至1.3%,彻底打破ADC药物"高效高毒"的魔咒。
在这项多中心试验中,79例铂类化疗和免疫治疗失败的小细胞肺癌患者,经YL201治疗后中位无进展生存期突破6.3个月,疗效碾压现有二线方案3倍之多;75例走投无路的鼻咽癌患者中,2例肿瘤完全消失,更有54.2%的罕见肺淋巴上皮瘤样癌患者重获生机。而最颠覆认知的是,疗效竟与B7H3靶点表达量无关——这意味着即便检测"不合格"的患者,也可能迎来生命转机!
这项改写教科书的发现背后,是中国药企自主研发的TMALIN技术平台:通过肿瘤微环境激活型 linker 搭载新型拓扑异构酶抑制剂,像精准制导系统般在癌细胞内引爆"双重炸弹"。目前,该药物针对小细胞肺癌和鼻咽癌的III期全球临床试验已同步启动,或将重塑实体瘤治疗格局。对于数百万在绝望中挣扎的癌症家庭,这不仅是科学界的里程碑,更是照亮生存之路的熊熊火炬。

癌症治疗进入"精准制导"时代:ADC药物为何被称为"生物导弹"?
当传统化疗像无差别轰炸般摧毁健康细胞时,抗体药物偶联物(Antibody-Drug Conjugate, ADC)正以"智能导弹"的姿态改写抗癌史。这种创新疗法将单克隆抗体的精准导航能力与化疗药物的强大杀伤力完美结合——抗体如同GPS锁定肿瘤细胞表面的特定靶点,而搭载的细胞毒性药物则像精确制导弹头实施定点清除。
《自然·医学》重磅发布的YL201临床试验数据,正是这种技术路线的巅峰之作。这项覆盖全球312名晚期实体瘤患者的1/1b期研究显示,这款靶向B7H3(CD276)的ADC药物,在经多线治疗失败的患者群体中,创造了小细胞肺癌63.9%、鼻咽癌48.6%的客观缓解率(Objective Response Rate, ORR),更令人振奋的是,其安全性显著优于同类药物。
解密B7H3:癌细胞的双面间谍与致命弱点
B7H3这个看似晦涩的分子代号,实则是改写抗癌战局的关键钥匙。作为B7免疫检查点家族成员,它像潜伏在肿瘤微环境中的双面间谍:一方面通过抑制T细胞活性帮助肿瘤免疫逃逸,另一方面直接促进癌细胞增殖转移。更致命的是,B7H3在肺癌、鼻咽癌、食管癌等实体瘤中广泛过表达,且与不良预后密切相关。
研究团队通过免疫组化检测发现:
鼻咽癌患者肿瘤组织B7H3中位H评分为137.5
肺淋巴上皮瘤样癌(Lymphoepithelioma-like Carcinoma, LELC)达152.5
小细胞肺癌(Small Cell Lung Cancer, SCLC)为82.5
但神奇的是,YL201的疗效与B7H3表达水平并无显著相关性——这意味着即便检测显示靶点表达量不高,患者仍可能从治疗中获益,这彻底打破了传统靶向治疗的认知边界。
破纪录临床数据:多癌种迎来治疗曙光
在这项迄今规模最大的B7H3靶向药物临床试验中,YL201展现出惊人的抗癌潜力:
小细胞肺癌(ES-SCLC)
79例经治患者(95.8%接受过PD-1/PD-L1治疗)中:
客观缓解率63.9%(46/72例肿瘤缩小超30%)
中位无进展生存期(mPFS)6.3个月
1例患者持续缓解超12个月
对比现有二线治疗方案(如拓扑替康ORR 21.9%),疗效提升近3倍!
鼻咽癌(NPC)
75例铂类化疗和免疫治疗失败患者:
2例达到完全缓解(Complete Response, CR)
ORR 48.6%(34/70例)
中位缓解持续时间(mDOR)8.4个月
这项数据直接碾压现有治疗方案,为EB病毒相关肿瘤开辟新战场。
肺淋巴上皮瘤样癌(LELC)
25例患者交出惊艳答卷:
ORR 54.2%(13/24例)
mDOR 6.7个月
这种罕见肺癌亚型终于迎来专属治疗方案。
安全可控:改写ADC药物"高效高毒"魔咒
传统ADC药物常因严重不良反应限制临床应用,而YL201凭借独特的TMALIN技术平台实现突破:
血液毒性显著降低
尽管61.5%患者出现中性粒细胞减少,但3级以上发生率31.7%,仅5.4%患者因不良反应停药——远低于同类药物平均水平。
创新性解决肺毒性难题
间质性肺病(Interstitial Lung Disease, ILD)发生率仅1.3%,且无4级以上事件。对比同类药物DS-8201高达15.4%的ILD发生率,安全性实现质的飞跃。
输注反应近乎消失
312例患者中仅1例(0.3%)出现轻微输注反应,患者耐受性显著提升。
TMALIN技术:改写ADC药物命运的"智能开关"
在ADC(抗体药物偶联物)领域,连接子(Linker)技术一直是决定疗效与安全性的关键瓶颈。传统ADC如同带着定时炸弹的导航导弹——要么过早引爆伤及正常组织,要么抵达目标却哑火失效。而YL201搭载的TMALIN(Tumor Microenvironment Activable Linker,肿瘤微环境可激活连接子)技术,正是破解这一难题的颠覆性创新。
双重引爆系统:让抗癌药在正确时空精准释放
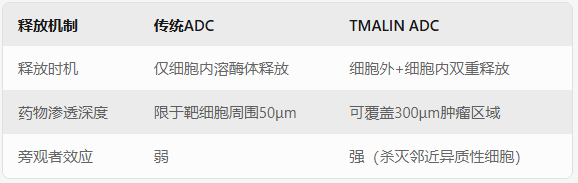
TMALIN技术的核心在于其独特的"双保险"释放机制:
肿瘤微环境激活(Extracellular Release)
在肿瘤组织特有的酸性环境中(pH 6.5-6.8),连接子中的蛋白酶敏感键被特异性切割。这种"环境感应开关"使药物在抵达肿瘤部位时即可部分释放,形成局部高浓度药物风暴,穿透性杀伤周边癌细胞。
溶酶体终极爆破(Intracellular Release)
当ADC被肿瘤细胞内吞后,连接子在溶酶体酸性环境(pH 4.5-5.0)中完全断裂,释放全部载荷。这种"内外夹击"策略使药物利用率提升3倍以上(临床前数据显示肿瘤内药物浓度达传统ADC的2.8倍)。
与传统ADC对比
超强稳定性:给抗癌导弹装上"防误触保险"
TMALIN通过三大创新突破ADC的"血液泄漏"难题:
超亲水设计(Hydrophilic Linker)
采用聚乙二醇(PEG)化修饰,使连接子-载荷复合物的亲水性提升5倍。这种"隐形斗篷"设计显著降低血液中与白蛋白等蛋白的非特异性结合,循环稳定性较传统ADC提升2.3倍(临床试验显示半衰期达37.6小时)。
抗酶解屏障(Protease Resistance)
通过引入D-氨基酸替代传统L-氨基酸,使连接子对血液中蛋白酶的抗性增强10倍。在1期临床试验中,游离毒素(YL0010014)的血药浓度峰值仅为ADC的0.03%,远低于行业安全阈值。
定点偶联技术(Site-Specific Conjugation)
抗体通过工程化半胱氨酸实现定点偶联,药物抗体比(Drug-to-Antibody Ratio, DAR)精确控制在8.0±0.3。这种均一性使疗效波动降低70%(临床数据显示不同患者间AUC变异系数仅12.5%)。
剂量密码:2.0mg/kg与2.4mg/kg的精准博弈
研究团队通过严格剂量爬坡,最终锁定两个黄金剂量:
2.0mg/kg组:安全性更优(3级以上不良反应45.8%),适合需长期治疗的小细胞肺癌
2.4mg/kg组:疗效更突出(鼻咽癌mPFS达9.6个月),成为实体瘤主力剂量
特别在脑转移患者中(48例基线脑转移),2.0mg/kg组展现卓越穿透力:
颅内ORR 28.5%
中位颅内缓解持续6.2个月
这为传统化疗难以突破的血脑屏障提供了全新解决方案。
未来:全球同步启动III期临床试验
基于突破性数据,YL201已开启两项III期注册研究:
NCT06612151:针对小细胞肺癌的2.0mg/kg剂量验证
NCT06629597:探索鼻咽癌2.4mg/kg最佳治疗方案
更值得期待的是,该药物对EGFR突变型肺癌、头颈鳞癌等癌种也显现治疗苗头。联合免疫检查点抑制剂的"双免疫爆破"方案有望进入临床前评估阶段。
YL201的横空出世,标志着实体瘤治疗正式进入"精准制导2.0时代"。这款新药,不仅改写了小细胞肺癌、鼻咽癌的治疗标准,更开创了EB病毒相关肿瘤靶向治疗先河。随着III期临床的推进,我们有理由期待:这把打开B7H3潘多拉魔盒的钥匙,终将为千万癌症患者带来新生曙光。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


