Cancer Immunology Immunotherapy:CD16xCD33双特异性杀伤细胞衔接器(BiKE)在小儿AML和双表型ALL患者中的潜在免疫治疗作用
来源:生物谷 2021-08-27 16:58
急性白血病是儿童中诊断出的最常见的恶性肿瘤,约占儿童癌症诊断的30%,绝大多数(80%) 患有急性淋巴细胞白血病(ALL),而其余的被诊断为急性髓性白血病(AML)。其中,大约25%的双表型或双系ALL表达髓系特异性抗原CD33,因此,CD33+白血病患者标志着一个高危人群,迫切需要新的策略来促进免疫系统克服恶性肿瘤而不增加进一步危及生命的毒性。自然杀伤(N
急性白血病是儿童中诊断出的最常见的恶性肿瘤,约占儿童癌症诊断的30%,绝大多数(80%) 患有急性淋巴细胞白血病(ALL),而其余的被诊断为急性髓性白血病(AML)。其中,大约25%的双表型或双系ALL表达髓系特异性抗原CD33,因此,CD33+白血病患者标志着一个高危人群,迫切需要新的策略来促进免疫系统克服恶性肿瘤而不增加进一步危及生命的毒性。自然杀伤(NK)细胞是先天免疫系统的关键参与者,能够进行免疫监视,其活性的调节受一系列激活和抑制受体的调节,最终,这些受体的平衡将决定NK细胞是否会对健康或恶性的“自我”保持沉默(耐受)、自身反应性或细胞毒性(同种异体反应性)。
图片来源:https://doi.org/10.1007/s00262-021-03008-0
不同的研究已经证明了通过CD16和单克隆治疗性抗体操纵NK细胞的治疗潜力,在这种情况下,双特异性抗体代表了一类新的单克隆抗体,可将肿瘤细胞上的表面抗原与细胞毒性淋巴细胞(如NK细胞)的效应细胞受体连接起来,从而产生抗肿瘤作用。为了更有效地将NK细胞引导至白血病靶点,研究者设计了一种完全人性化的双特异性杀伤细胞接合器。 CD16xCD33 BiKE包含两个抗体片段,第一个识别CD16 (FcγRIII),第二个针对骨髓分化抗原CD33,它们共同触发抗体依赖性细胞介导的细胞毒性。针对CD33+靶标的CD16信号传导是NK细胞特异性的,并且专门针对CD33+细胞,因此,抗体通过CD16直接触发NK细胞活化,显着增加NK细胞的细胞毒性和细胞因子的产生。此外,通过这种方式,CD16xCD33 BiKE已被证明有可能克服KIR信号传导的抑制作用,并改善NK细胞介导的成人AML原始细胞裂解。该研究评估了CD16xCD33 BiKE是否可以增强NK细胞对CD33+原发性儿童ALL和AML细胞的激活。
CD16xCD33 BiKE可增强NK细胞脱粒作用和针对CD33+细胞系的细胞因子释放 图片来源:https://doi.org/10.1007/s00262-021-03008-0
该研究确定了CD16xCD33 BiKE构建体的敏感性,涉及原代双表型儿童ALL原始细胞上CD33 低表达水平的问题,因此,测试了CD16xCD33 BiKE是否不仅针对CD33hi HL60细胞系而且针对CD33lo SEM细胞系诱导NK细胞效应器功能,显示出低至非常低的CD33表达谱,与CD33+ 原代ALL原始细胞相当。此外,还比较了白细胞介素对CD16xCD33 BiKE刺激的额外贡献,通过添加等效摩尔浓度(250U)的IL-2、IL-15或两者,可以进一步增加CD107a(为NK细胞的抑制受体)脱粒和细胞因子的产生。为了评估抗体的治疗潜力,来自健康志愿者的外周血单核细胞(PBMC)用CD16xCD33处理并分别与CD33hi HL60和CD33lo SEM细胞共培养,然后通过流式细胞术评估NK细胞脱粒、TNF-α 和IFN-γ的产生,并通过CFSE(一种荧光染料)细胞毒性测定法评估NK细胞介导的杀伤。与用CD16xCD33处理的条件相比,没有抗体的对照条件不会增加NK细胞脱颗粒和细胞因子的产生,在CD33hi HL60或CD33lo SEM细胞存在的情况下,通过添加CD16xCD33 BiKE显著增加NK细胞脱粒和细胞因子的产生。SEM细胞相对较低的CD33表达水平显然足以通过与CD16xCD33 BiKE桥接来刺激NK细胞效应器功能,对NK细胞介导的细胞毒性进行了类似的观察:CD16xCD33 BiKE诱导的靶细胞死亡,与CFSE测定结果一致。
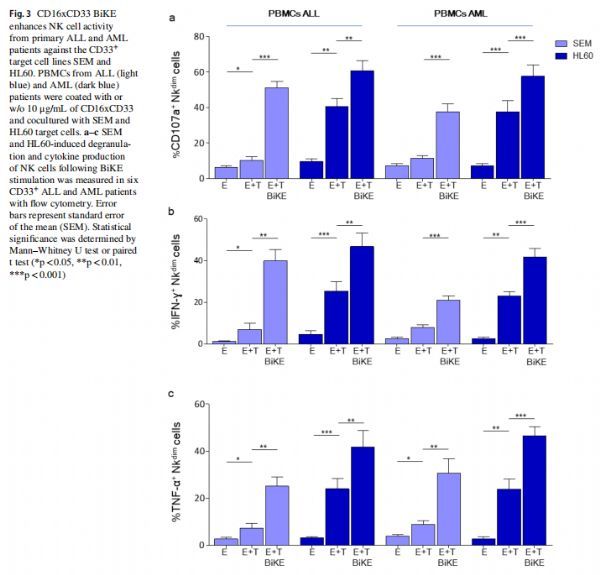
CD16xCD33 BiKE可增强针对小儿ALL和AML的脱粒和细胞因子产生 图片来源:https://doi.org/10.1007/s00262-021-03008-0
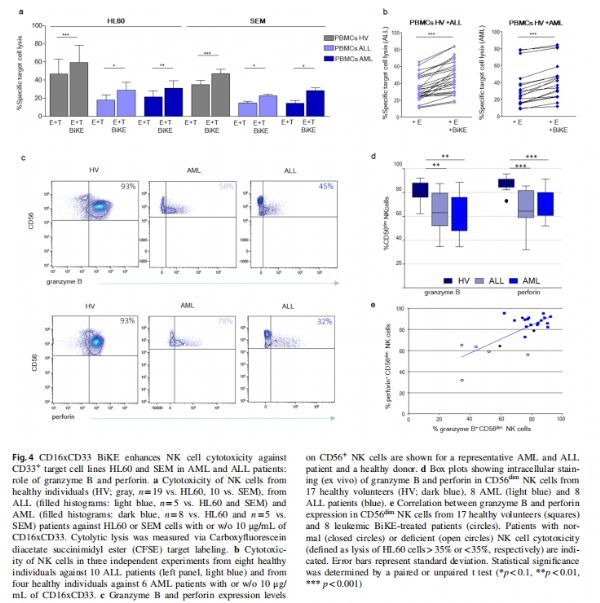
CD16xCD33 BiKE增强NK细胞对AML和ALL患者中CD33+靶细胞系HL60和SEM的细胞毒性:颗粒酶B和穿孔素的作用 图片来源:https://doi.org/10.1007/s00262-021-03008-0
该研究比较了健康同种异体NK细胞对原代ALL和AML母细胞的效应功能和杀伤能力,将解冻的PBMC与CD16×33 BiKE一起孵育,并与原代 ALL或AML母细胞共培养4小时。BiKE治疗导致来自健康志愿者的NK细胞中CD107+细胞毒性颗粒的动员和细胞毒性显著增加,以对抗原发性ALL和AML母细胞,这突显出未经BiKE治疗的NK细胞的抗白血病功能不足,这同样适用于IFN-y和TNF-α 的细胞因子产生,这可以通过添加CD16xCD33 BiKE显著增强。CD33在原代原始细胞上的百分比与NK效应子功能之间的相关性对于NK细胞脱粒(CD107a)似乎非常显著(p = 0.003),但无法观察到较高的CD33表达水平与细胞因子产生之间的相关性,这些数据表明CD16xCD33 BiKE诱导健康供体NK细胞针对表达CD33的肿瘤靶标的大量激活。由于BiKE治疗导致了正常动员但细胞毒性受损,研究者探讨了颗粒是否适当地配备了细胞毒性分子颗粒酶B和穿孔素,两种分子的细胞内染色显示,与健康志愿者相比,来自 ALL和AML患者的大多数CD56dim NK细胞中细胞毒性颗粒的武装显著减少,在大多数情况下,两种分子同时减少表明功能缺陷的NK细胞表型。在表现出最高水平穿孔素和颗粒酶的两个样品中测量到最高的杀灭效率,表明通过BiKE刺激后细胞毒性NK细胞反应的降低至少可以部分解释为白血病患者NK细胞中颗粒酶B和穿孔素的水平降低。
CD16xCD33 BiKE增强原发ALL和AML患者的NK细胞对CD33+靶细胞系SEM和HL60的活性 图片来源:https://doi.org/10.1007/s00262-021-03008-0
研究者测试了CD16xCD33 BiKE增加白血病患者NK细胞对CD33+靶细胞的CD107a动员、细胞因子产生和细胞毒性的能力,发现在CD33hi HL60存在下添加CD16xCD33 BiKE显着增加了NK细胞脱粒和细胞因子的产生。然而,患者NK细胞对靶细胞的杀伤只能通过CD16xCD33 BiKE适度增加,在ALL和AML患者中观察到显著上调。
研究发现不仅在细胞表面持续表达CD33的小儿AML,而且以较差的预后为特征的CD33+ALL都是CD16xCD33 BiKE的潜在靶点。研究者鼓励在儿科AML和CD33+ALL患者中实施和评估这种具有成本效益的现成产品,特别是在与CD19丢失相关的CD33+ALL复发中,这些物质可作为潜在的维持治疗或造血干细胞移植前的“桥接”巩固化疗。(生物谷 bioon)
参考文献
Sarah B. Reusing et al. CD16xCD33 Bispecific Killer Cell Engager (BiKE) as potential immunotherapeutic in pediatric patients with AML and biphenotypic ALL. CANCER IMMUNOLOGY IMMUNOTHERAPY (2021 Aug 16) doi:https://doi.org/10.1007/s00262-021-03008-0
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。