《自然·通讯》:武汉大学团队发现,免疫细胞释放的特定外囊泡竟会助长肿瘤气焰!
来源:奇点糕 2024-05-16 09:12
研究团队利用HNSCC患者血液样本发现,同时结合循环sEVs上的PD-L1、PD-1、CD80水平进行分析,相比于单独指标,用于预测PD-1抑制剂治疗反应的效果更佳。
武汉大学的陈刚团队于近日发表在《自然·通讯》杂志上的最新研究[1],首次揭示携带免疫检查点蛋白PD-1和CD80的sEVs在抗肿瘤免疫过程中扮演的角色。
他们发现,由T细胞产生的PD-1/CD80阳性sEVs能够引导肿瘤细胞表达的PD-L1重新分布,使PD-L1内化并通过sEVs分泌至血液循环,从而导致全身的免疫抑制。同时,这些囊泡还能够降低肿瘤细胞的黏附和抗原呈递功能、损害免疫细胞的浸润,推动肿瘤发展为免疫“冷”表型。
同时监测循环sEV上的PD-1、CD80、PD-L1水平,能够更好地预测癌症患者对免疫治疗的反应。

论文首页截图
之前的研究表明,小细胞外囊泡(sEVs)在体内循环中承载着PD-L1等免疫检查点蛋白,能够独立于细胞间直接接触的方式作用于T细胞,发挥全身的免疫抑制效应。除了PD-L1,尽管人们早在2017就已经在循环sEVs上找到PD-1、CD80的身影[2],但其功能在免疫治疗中的作用仍然是一片空白。
在这项研究中,陈刚团队首先从36位健康捐献者和46位头颈部鳞状细胞癌(HNSCC)患者的外周血样本中提取sEVs,对其进行表征和定量分析。患者中有23名在肿瘤复发后接受过PD-1抑制剂治疗,部分患者对治疗反应不佳。
结果显示,所有测试的免疫检查点蛋白中,循环sEV上的PD-L1、PD-1、CD80水平高,被证明与HNSCC患病以及患者对PD-1抑制剂治疗无反应或治疗预后不良密切相关。
其中,研究团队发现,PD-1和CD80往往同时出现在同一个循环sEVs上。PD-L1虽然不与之同行,但在PD-L1阳性患者体内,PD-L1+sEVs与PD-1/CD80+sEVs水平呈正相关。
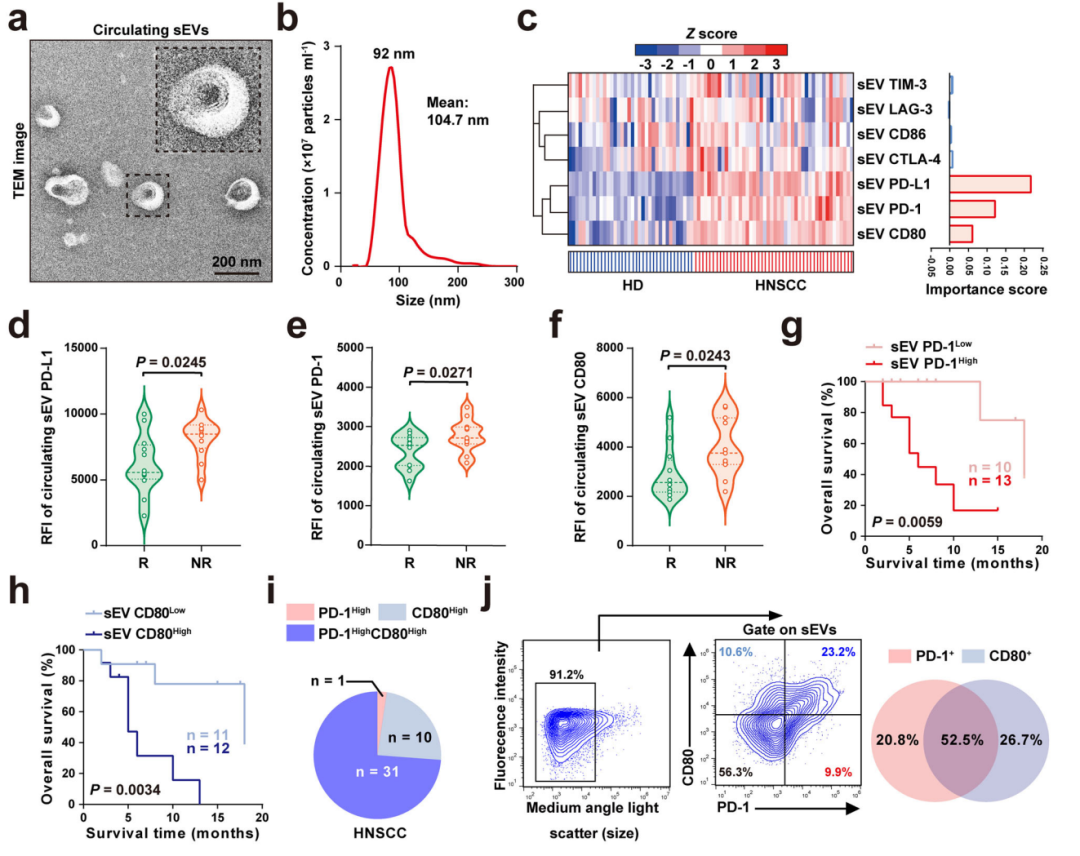
血液样本中PD-1/CD80阳性sEVs水平与HNSCC患者对免疫治疗的反应相关
研究团队在小鼠实验中对以上结果进行验证,并表明血液循环PD-1/CD80+sEVs的主要来源是活化T细胞,具有明显的免疫抑制特性。
从机制上来看,活化T细胞衍生的PD-1/CD80+sEVs在循环中遇到肿瘤细胞后,与其表面的PD-L1直接作用并激活肿瘤细胞内信号通路,通过ECSRT途径促使PD-L1等信号分子被内吞,并以sEVs装载的形式由肿瘤细胞分泌。PD-L1+sEVs进入血液循环,引起全身的适应性免疫抑制。
值得注意的是,陈刚团队在之前的工作中提出,IFN-γ也会促使肿瘤细胞分泌PD-L1+sEVs[3]。但是此次经过对比,研究团队表示,PD-1/CD80+sEVs和IFN-γ看似异曲同工,实则相背而行:
除了引起循环PD-L1+sEVs水平增加,PD-1/CD80+sEVs还有一项关键技能,即下调肿瘤细胞表面的PD-L1以及抗原提呈相关的MHC-I分子、细胞黏附相关的ICAM-1分子水平,从而降低肿瘤免疫原性和免疫细胞浸润,驱使肿瘤转变为免疫“冷”表型。与之不同,IFN-γ的作用方式并不依赖于ECSRT内吞途径,反倒是会引起肿瘤细胞表达更多的PD-L1、MHC-I、ICAM-1,相当于给肿瘤“加热”。
而且与IFN-γ处理相比,PD-1/CD80+sEVs促使肿瘤细胞分泌的PD-L1+sEVs还带有更多的“别吃我”信号CD47,表明巨噬细胞对其清除效率更低。再加上脂双分子层的特殊结构保护,PD-1/CD80+sEVs相比于IFN-γ能够在循环中更稳定和远距离迁移,产生更强的抗肿瘤免疫抑制作用。
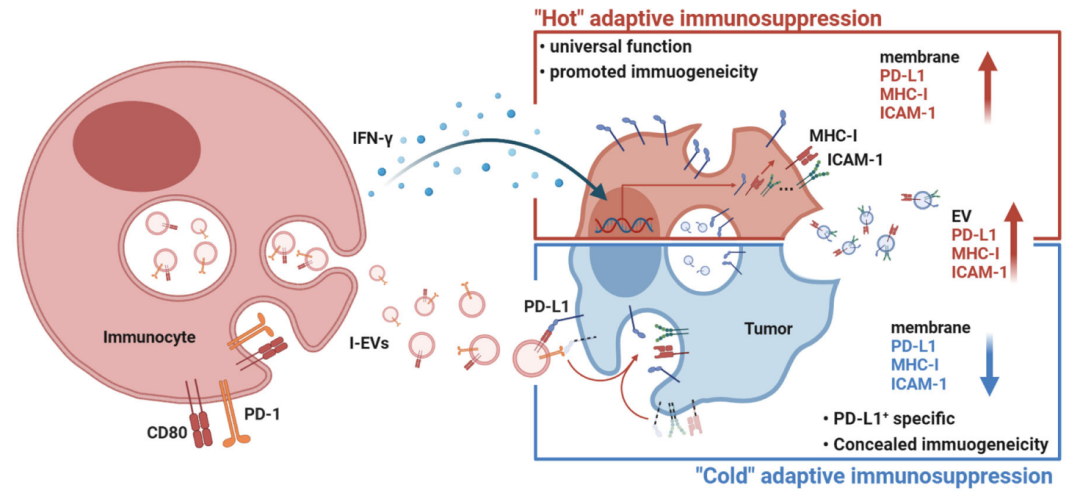
机制
给黑色素瘤小鼠或结直肠癌小鼠尾静脉注活化T细胞衍生的sEVs,会使小鼠肿瘤体积增长近一倍、小鼠寿命缩短,并明显减弱PD-1抑制剂的免疫治疗效果,导致肿瘤浸润CD8阳性T细胞数量减少;若在注射前预先处理,对其表达的PD-1/CD80进行阻断,可以挽救这些效果。
最后,研究团队利用HNSCC患者血液样本发现,同时结合循环sEVs上的PD-L1、PD-1、CD80水平进行分析,相比于单独指标,用于预测PD-1抑制剂治疗反应的效果更佳。并基于这些发现,他们提出了一个适用于临床实践的新工作流程,区分可能对免疫治疗有反应和无反应的患者,从而实现更有针对性的治疗策略。
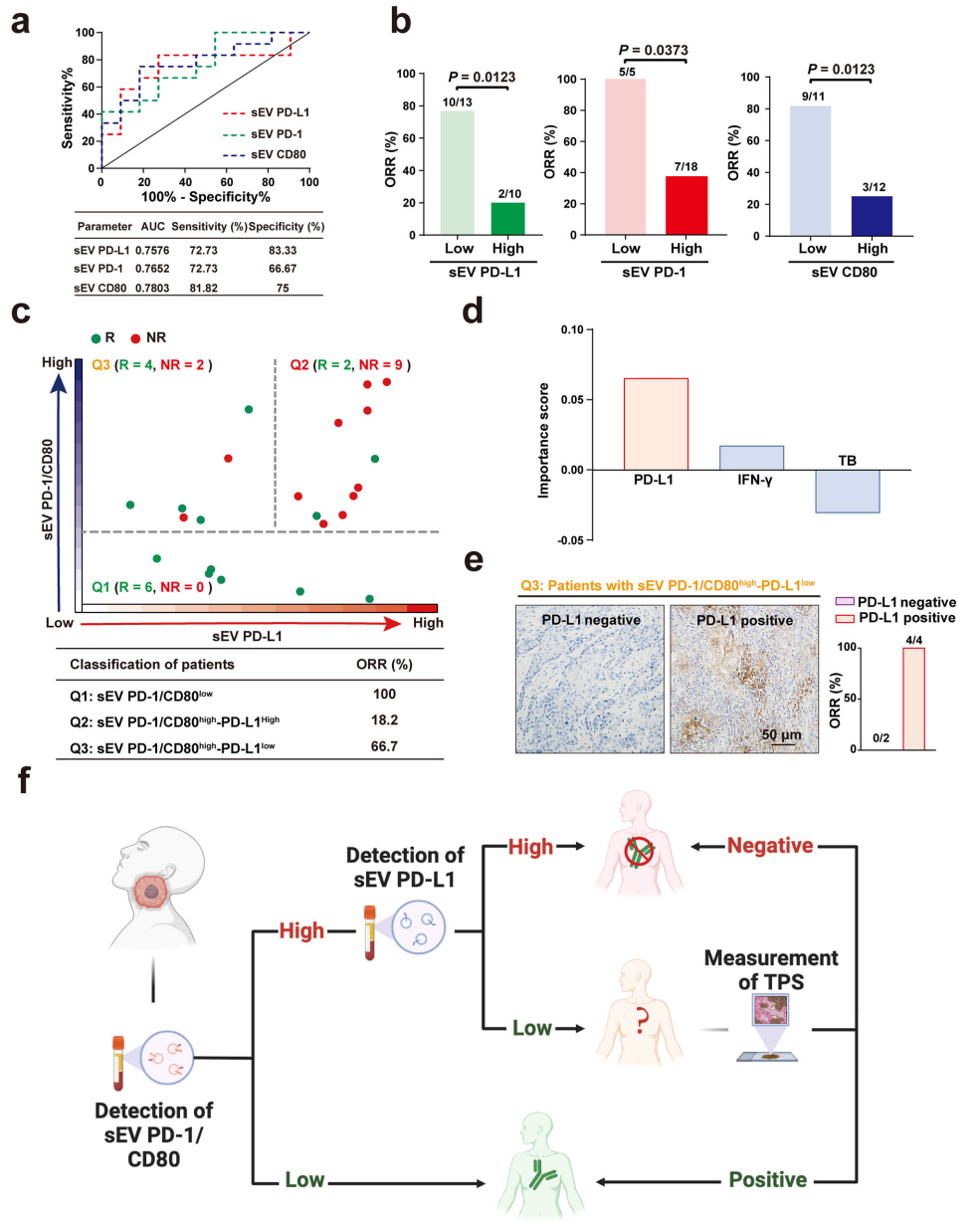
结合sEVs上的多个免疫检查点进行预测效果更佳
除了其抗肿瘤免疫抑制作用,研究团队推断,PD-1/CD80+sEVs还可能通过消耗PD-1抑制剂,降低其治疗效果。总之,更全面地了解循环sEV携带的多个免疫检查点,可能是克服免疫抑制和提高抗肿瘤治疗疗效的关键。
参考文献:
[1]Zhang, LZ., Yang, JG., Chen, GL. et al. PD-1/CD80+ small extracellular vesicles from immunocytes induce cold tumours featured with enhanced adaptive immunosuppression. Nat Commun 15, 3884 (2024). https://doi.org/10.1038/s41467-024-48200-9
[2]Ludwig, S. et al. Suppression of lymphocyte functions by plasma exosomes correlates with disease activity in patients with head and neck cancer. Clin. Cancer Res. 23, 4843–4854 (2017).
[3]Chen, G. et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature 560, 382–386 (2018).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


