Cell子刊:类器官研究揭示胰腺癌代谢分型并发现治疗新靶点
来源:生物世界 2023-08-28 11:23
进一步整合多组学发现,GLUT1/ALDOB/G6PD代谢轴在Glucomet-PDAC代谢重编程过程中发挥重要作用。首先,在Glucomet-PDAC中,Glut1高表达,转运更多的葡萄糖进入肿瘤细
该研究系统揭示胰腺导管腺癌(PDAC)的代谢组学特征,并通过整合代谢组、全基因组、转录组和药物敏感性等多组学数据提出不同代谢亚型的化疗敏感性机制及潜在治疗靶点。

研究团队以28例胰腺癌类器官为模型,系统性收集了代谢组学、全基因组学、转录组学、染色质开放性以及药物敏感性信息。利用代谢组学对PDAC进行分型,鉴定了2种代谢亚型,分别富集糖代谢(Glucomet-PDAC)和脂代谢(Lipomet-PDAC)。与Lipomet-PDAC相比,Glucomet-PDAC对化疗更抵抗,同时具有Glucomet-PDAC特征的病人预后更差。
进一步整合多组学发现,GLUT1/ALDOB/G6PD代谢轴在Glucomet-PDAC代谢重编程过程中发挥重要作用。首先,在Glucomet-PDAC中,Glut1高表达,转运更多的葡萄糖进入肿瘤细胞。其次,ALDOB表达的降低释放了G6PD的活性,提高了氧化型戊糖磷酸途径的代谢通量。氧化型戊糖磷酸途径代谢通量的增加在Glucomet-PDAC中合成了更多参与DNA合成原料,诱导了其对化疗药物的耐药性。在Glucomet-PDAC中敲低GLUT1、过表达ALDOB或者敲低G6PD都可以导致细胞对化疗药物敏感性的增加。同样,GLUT1和G6PD的抑制剂在体内外都可增加PDAC对化疗药物的敏感性。
最后,通过虚拟筛选及体内外验证,发现Aurora的两个临床抑制剂MLN8054及Alisertib可以有效抑制G6PD的活性并增加化疗药物的敏感性。该研究揭示了与PDAC化疗敏感性相关的潜在代谢异质性,并通过化疗和GLUT1/ALDOB/G6PD轴抑制剂的组合为化疗耐药性glucomet-PDAC患者开发了一种有希望的药理学策略。
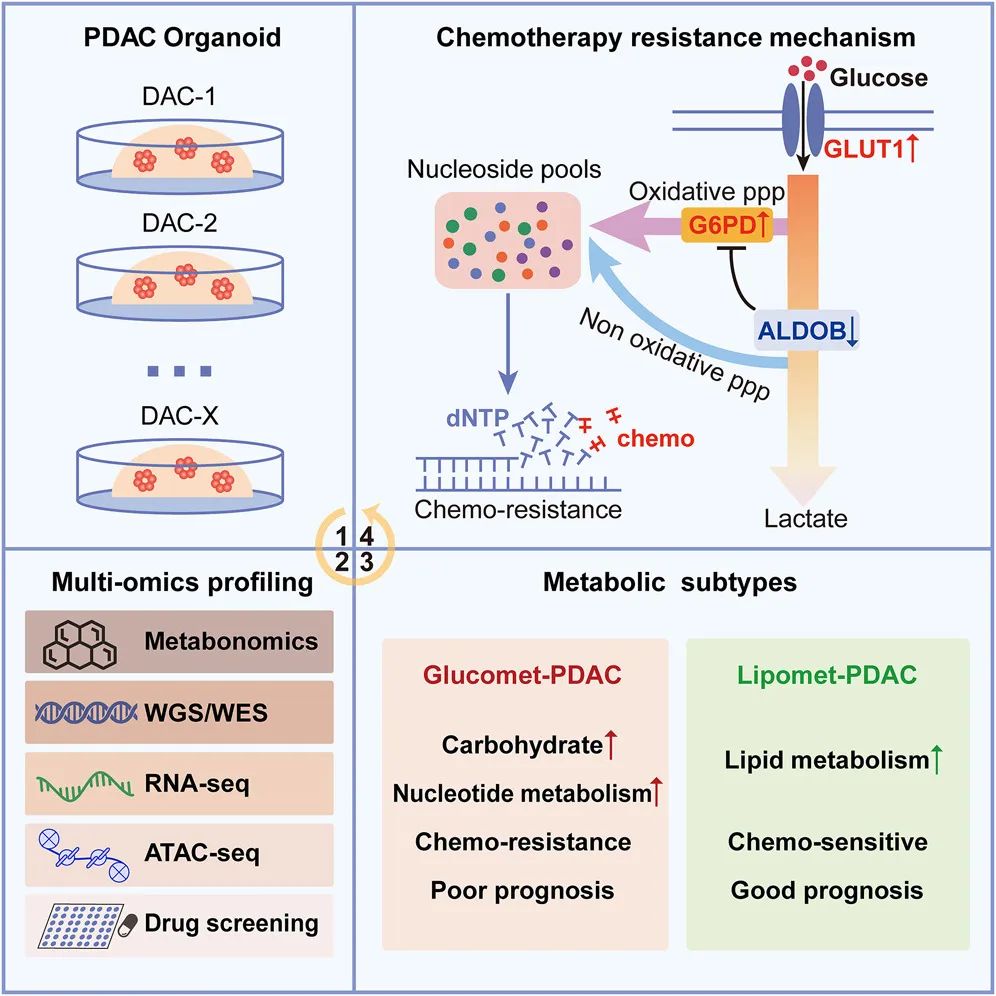
胰腺癌代谢分型及其重编程诱导的耐药模式图
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


