《癌症通讯》:突破!仁济医院团队用CAR-T细胞让两名晚期肝癌患者实现临床治愈
来源:奇点糕 2023-11-07 13:53
如果上述假设可以在更大规模的临床研究中证实,那对于实体瘤的治疗将产生巨大的影响。
国际癌症研究机构(IARC)去年发布的数据显示,我国每年新发肝癌超过41万例,因肝癌死亡超过39万例,分别占全球的45.3%和47.1%[1]。更让人触目惊心的是,我国肝癌患者的5年生存率只有12.1%[2]。
对于合并下腔静脉癌栓(IVCTT)的肝癌患者而言,他们不仅缺乏有效的治疗手段,而且预后极差。有研究表明,此类患者术后的中位总生存期仅为17.76个月[3];而接受其他局部或系统性治疗的患者,中位总生存期也仅为5.88至15.36个月[3-5],因此亟需新的治疗方案改善患者的预后。
近日,上海交通大学医学院附属仁济医院翟博领衔的研究团队,在著名期刊《癌症通讯》上以封面论文的形式,发表了的一项重磅研究成果[6]。
两名复发性晚期肝癌患者,在接受局部治疗(微波消融和伽马刀)控制肝内肿瘤、下腔静脉癌栓和转移灶之后,接受了靶向GPC3的CAR-T细胞(CAR-GPC3 T细胞)治疗,最终都获得了超过5年的无病生存期和超过8年的总生存期,实现了临床治愈。
翟博团队认为,这一结果表明,CAR-T细胞或许可以消除术后实体瘤的微小病灶和循环肿瘤细胞(CTC),从而实现抑制实体肿瘤的复发。

论文首页截图
GPC3(Glypican-3)在肝癌细胞表面高表达,而且GPC3表达水平越高,肝癌患者预后越差。
还有研究发现,在其他组织或器官中,GPC3表达水平较低,因此,GPC3被认定为肝癌预后和治疗的潜在靶点。
早在2015年,仁济医院肿瘤介入科就开始探索用靶向CAR-GPC3 T细胞治疗肝癌,并发起了全球首个临床试验[7]。这两名患者就是在那个时候入组的,接下来我们就逐一看看这两名患者的治疗史。

封面报道
第一名患者是一名50岁的男性,患有乙型肝炎肝硬化,于2014年12月确诊为Ib期肝细胞癌。经过两次经导管肝动脉化疗栓塞术(TACE)治疗后,这个患者的病情达到了部分缓解,于是在2015年3月接受了微波消融(MWA)。
遗憾的是,这名患者的病情进展迅速,在接受微波消融后6周内出现下腔静脉癌栓。由于经济原因,患者放弃了系统性治疗,自愿加入了翟博团队发起的临床试验(NCT02395250)。
入组后,医生采用微波消融处理了肝脏病灶,用伽马刀处理了下腔静脉癌栓。随后,接受了自体CAR-GPC3 T细胞治疗回输治疗。
令人欣慰的是,这名患者的甲胎蛋白(AFP)从第14天的1210纳克/毫升迅速降至121纳克/毫升,并在接下来的两个月内逐渐恢复到正常范围。在使用CAR-GPC3 T细胞后,患者未接受其他任何治疗,尽管如此,这名患者已超过5年未检测到癌症迹象,总生存时间超过8年。值得一提的是,在这名患者的主要器官中未观察到与CAR-GPC3 T细胞治疗相关的毒性反应。
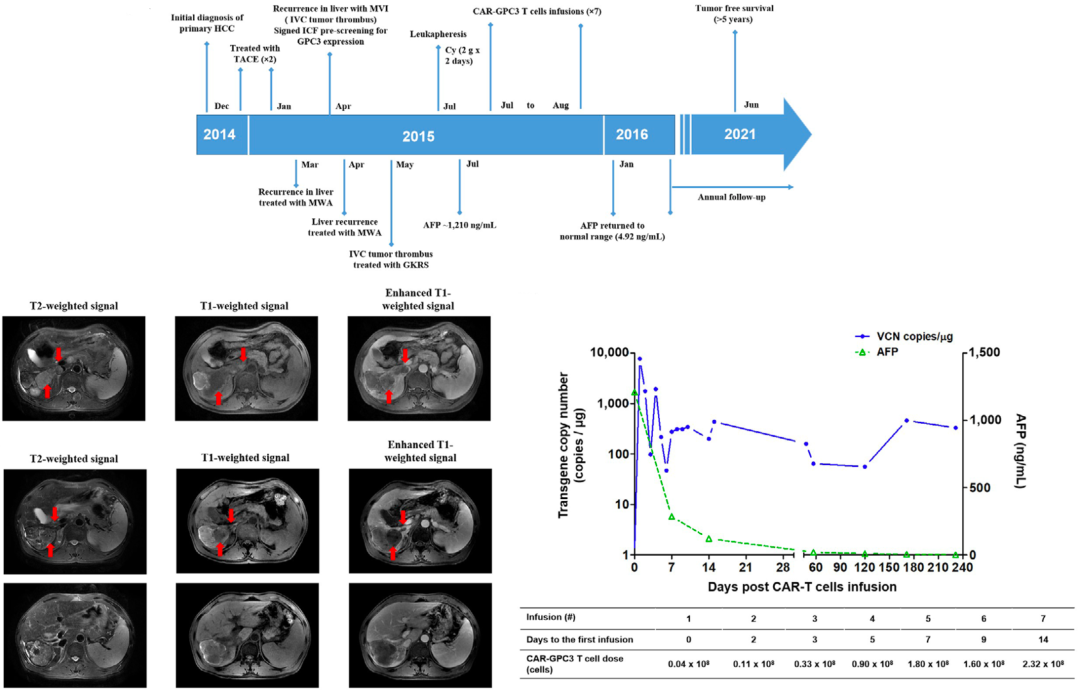
第一名患者的基本情况
第二名患者是一名54岁的男性,患有乙型肝炎肝硬化,被诊断为Ib期肝癌,并于2014年12月接受了手术切除治疗。
手术6周后,肿瘤复发。2015年2月至6月期间,这名患者又接受了一次经导管肝动脉化疗栓塞术治疗和两次微波消融治疗。遗憾的是,这些治疗没有控制住肿瘤,到2015年7月,磁共振成像(MRI)显示病情迅速进展,出现肝脏复发、下腔静脉癌栓和腹膜后淋巴结转移。
2015年8月,患者接受了伽马刀治疗下腔静脉癌栓;同年10月接受了两次微波消融处理肝脏复发肿瘤。最终这名患者也自愿加入了临床研究,接受了自体CAR-GPC3 T细胞治疗。
与第一位患者一样,这位患者也在未接受其他进一步抗癌治疗的情况下,保持无病状态超过5年,总生存时间超过8年。至于CAR-GPC3 T细胞治疗的不良反应,仅在输注过程中出现了发热、疲劳、一过性白细胞减少、血小板减少和1级细胞因子释放综合征。到2023年3月的最后一次电话随访,这名患者的身体状况仍良好。
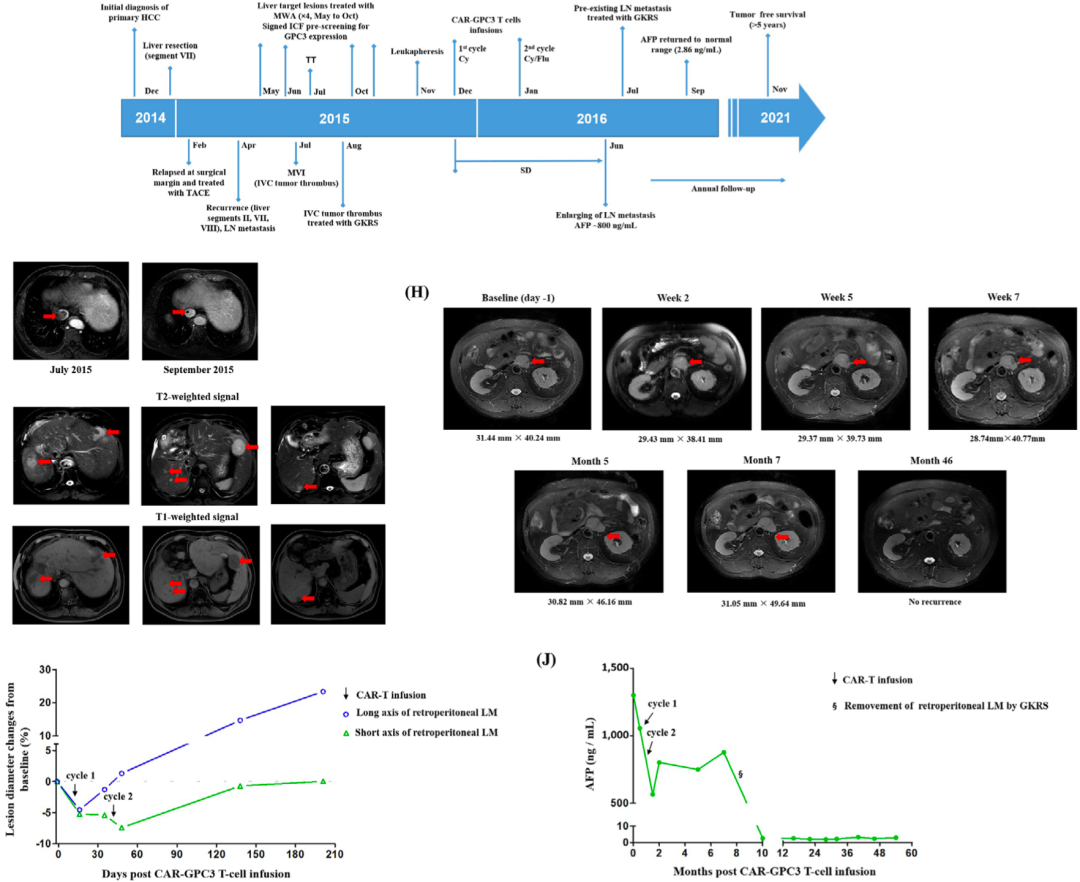
第二名患者的治疗情况
以上两名患者的治疗结局鼓舞人心。
众所周知,虽然CAR-T细胞改写了血液恶性肿瘤的治疗范式,但是对于实体瘤CAR-T细胞治疗鲜有成功案例。制约CAR-T细胞治疗实体瘤疗效的原因有很多,其中最关键的两个就是肿瘤的免疫抑制微环境和T细胞浸润肿瘤难度大。
在这个研究中,翟博团队先采用局部治疗方案,清除影像学可见的肿瘤病灶,然后再上CAR-T细胞,有效解决了肿瘤微环境对CAR-T细胞的不良影响。更重要的是,这两例成功的案例,也验证了一个假设——CAR-T细胞可以清除影像不可见的病灶和循环肿瘤细胞,进而达到抑制肿瘤卷土重来的目的。
如果上述假设可以在更大规模的临床研究中证实,那对于实体瘤的治疗将产生巨大的影响。
参考文献:
[1].Rumgay H, Arnold M, Ferlay J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040. J Hepatol. 2022;77(6):1598-1606. doi:10.1016/j.jhep.2022.08.021
[2].Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries. Lancet Glob Health. 2018;6(5):e555-e567. doi:10.1016/S2214-109X(18)30127-X
[3].Kokudo T, Hasegawa K, Matsuyama Y, et al. Liver resection for hepatocellular carcinoma associated with hepatic vein invasion: A Japanese nationwide survey. Hepatology. 2017;66(2):510-517. doi:10.1002/hep.29225
[4].Lou J, Li Y, Liang K, et al. Hypofractionated radiotherapy as a salvage treatment for recurrent hepatocellular carcinoma with inferior vena cava/right atrium tumor thrombus: a multi-center analysis. BMC Cancer. 2019;19(1):668. Published 2019 Jul 5. doi:10.1186/s12885-019-5870-3
[5].Rim CH, Jeong BK, Kim TH, et al. Effectiveness and feasibility of external beam radiotherapy for hepatocellular carcinoma with inferior vena cava and/or right atrium involvement: a multicenter trial in Korea (KROG 17-10). Int J Radiat Biol. 2020;96(6):759-766. doi:10.1080/09553002.2020.1721607
[6].Shi Y, Shi D, Chi J, et al. Combined local therapy and CAR-GPC3 T-cell therapy in advanced hepatocellular carcinoma: a proof-of-concept treatment strategy. Cancer Commun (Lond). 2023;43(9):1064-1068. doi:10.1002/cac2.12472
[7].Shi D, Shi Y, Kaseb AO, et al. Chimeric Antigen Receptor-Glypican-3 T-Cell Therapy for Advanced Hepatocellular Carcinoma: Results of Phase I Trials. Clin Cancer Res. 2020;26(15):3979-3989. doi:10.1158/1078-0432.CCR-19-3259
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


