Science重磅:in vivo CAR-T,在体内成功改造T细胞治疗癌症及自身免疫病,已开展临床试验
来源:生物世界 2025-06-21 16:49
在啮齿类动物模型和非人灵长类动物模型中,该公司专有的靶向脂质纳米颗粒(tLNP)成功将 CAR mRNA 靶向递送到体内的 CD8+ T 细胞,显示出对癌症和自身免疫疾病良好的治疗前景和安全性。
2022 年初,宾夕法尼亚大学的研究人员在 Science 期刊发表了一篇重磅研究论文【1】,开发了一种在体内原位生成 CAR-T 细胞的新技术(in vivo CAR-T),通过注射脂质纳米颗粒(LNP)递送 mRNA,在体内重编程 T 细胞,使其识别心脏纤维化细胞,从而治疗心脏纤维化疾病。该方法类似于 mRNA 疫苗,仅需简单注射,就能在体内生成 CAR-T 细胞疗法,有望解决当前 CAR-T 细胞疗法工艺复杂、周期长、价格高昂等关键难题。
不久后,该团队创立了一家名为 Capstan Therapeutics 的公司,致力于将 in vivo CAR-T 技术应用于癌症、自身免疫疾病及纤维化疾病的治疗,该公司目前以获得来自多家制药巨头及风投机构的 3.4 亿美元融资。该公司的创始团队包括 Carl June(CAR-T 细胞治疗先驱),Drew Weissman(诺奖得主、mRNA 技术奠基人),Jonathan Epstein(in vivo CAR-T 技术发明人)。
2025 年 6 月 11 日,Capstan 公司宣布,其 CAR-T 细胞疗法 CPTX2309(anti-CD19 in vivo CAR-T)正式开始 1 期临床试验,用于治疗 B 细胞介导的自身免疫疾病。
2025 年 6 月 19 日,Capstan 公司及宾夕法尼亚大学的研究人员在 Science 期刊发表了题为:In vivo CAR T cell generation to treat cancer and autoimmune disease 的研究论文【2】。
该论文介绍了 in vivo CAR-T 的临床前实验结果,在啮齿类动物模型(人源化小鼠)和非人灵长类动物模型(食蟹猴)中,该公司专有的靶向脂质纳米颗粒(tLNP)成功将 CAR mRNA 靶向递送到体内的 CD8+ T 细胞,显示出对癌症和自身免疫疾病良好的治疗前景和安全性。
自2017 年以来,美国 FDA 已批准了 6 款用于治疗各种 B 细胞恶性肿瘤的 CAR-T 细胞疗法,此外,全世界范围内还有数百种自体和异体 CAR-T 细胞及 CAR-NK 细胞产品正在临床试验中。
这些体外细胞疗法在为晚期和难治性癌症患者提供持久反应方面取得了显著成功,然而,该领域还存在诸如生产制造方面的挑战(成本、时间和规模)、地域限制、能够进行 CAR-T 细胞治疗的专业医学中心数量有限、需要进行淋巴细胞清除化疗,以及病毒载体的潜在安全性问题,严重限制了 CAR-T 细胞疗法的临床应用。
最近,CAR-T 细胞疗法在治疗 B 细胞介导的自身免疫疾病方面显示出巨大潜力,靶向 B 细胞的 CAR-T 细胞疗法在系统性红斑狼疮、肌炎、系统性硬化症、重症肌无力等疾病中展现了显著且持久的临床益处。
这些自身免疫疾病患者人群要比 B 细胞恶性肿瘤患者人群大的多,仅在美国就有 2000 万人,全世界约有 10% 的人口受某种自身免疫疾病的困扰。面对如此庞大的患者群体,需要一种可扩展、现货型、不含细胞及整合型病毒载体、无需化疗预处理、可在非专业医疗中心进行给药的新疗法。无需进行淋巴细胞清除化疗的 in vivo CAR-T 技术,有望满足这些要求。
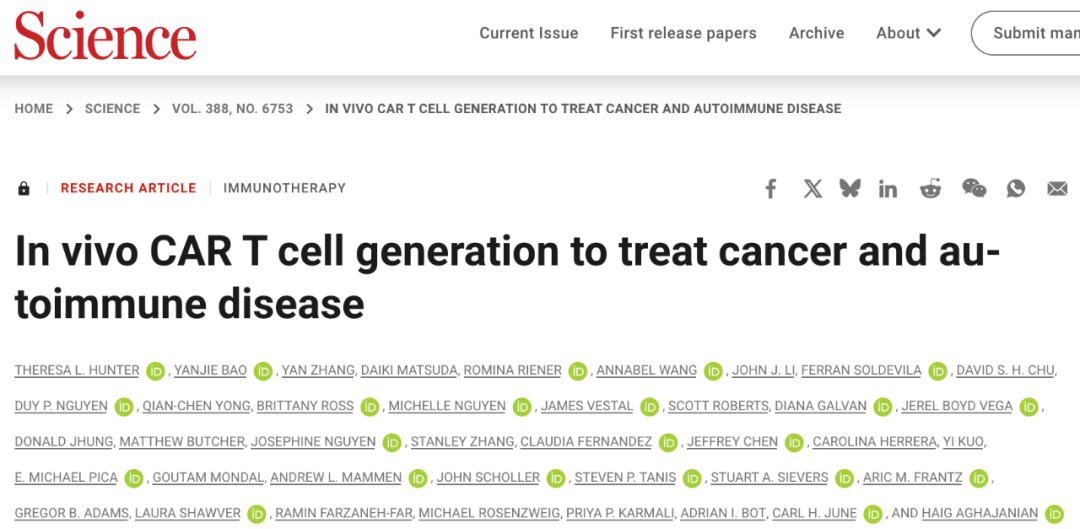
在这项最新研究中,研究团队开发了一种新型可电离脂质 L828,并优化了 LNP 配方,从而开发了新型靶向脂质纳米颗粒(tLNP),其在肝脏中的积累显著降低,通过在 tLNP 表面偶联 anti-CD5 抗体,进一步实现对脾脏中免疫细胞的特异性靶向。
在自身免疫疾病中,CD4+ CAR-T 细胞可能会产生不良影响,此外,CD4+ CAR-T 细胞还是细胞因子释放综合征(CRS)的主要驱动因素。为了实现对 CD8+ T细胞的特异性靶向,研究团队将 anti-CD8 抗体与 L829-LNP 进行了偶联,结果显示,在人源化小鼠模型中,CD8-L829-tLNP 更倾向于改造人 CD8+ T 细胞而非 CD4+ T 细胞,CD8-L829-tLNP 递送 anti-CD19 CAR mRNA 可在血液、脾脏、骨髓和淋巴结中迅速改造 CD8+ T 细胞,并表现出抗原特异性细胞毒性、增殖和细胞因子产生。
此外,研究团队还对 anti-CD19 CAR mRNA 的非编码区(UTR)和密码子进行了优化,设计出了优化的 CAR2 序列,具有更高的表达水平和肿瘤细胞杀伤效果。
接下来,研究团队进行了验证实验,研究团队从自身免疫疾病患者及健康供体获得了外周血单个核细胞(PBMC),结果显示,二者的 CD8+ T细胞在表型上相似,均被 CD8-L829-tLNP 改造为 CAR-T 细胞,且自身免疫疾病患者来源的改造 CAR-T 细胞能够有效杀伤其自体 B 细胞。
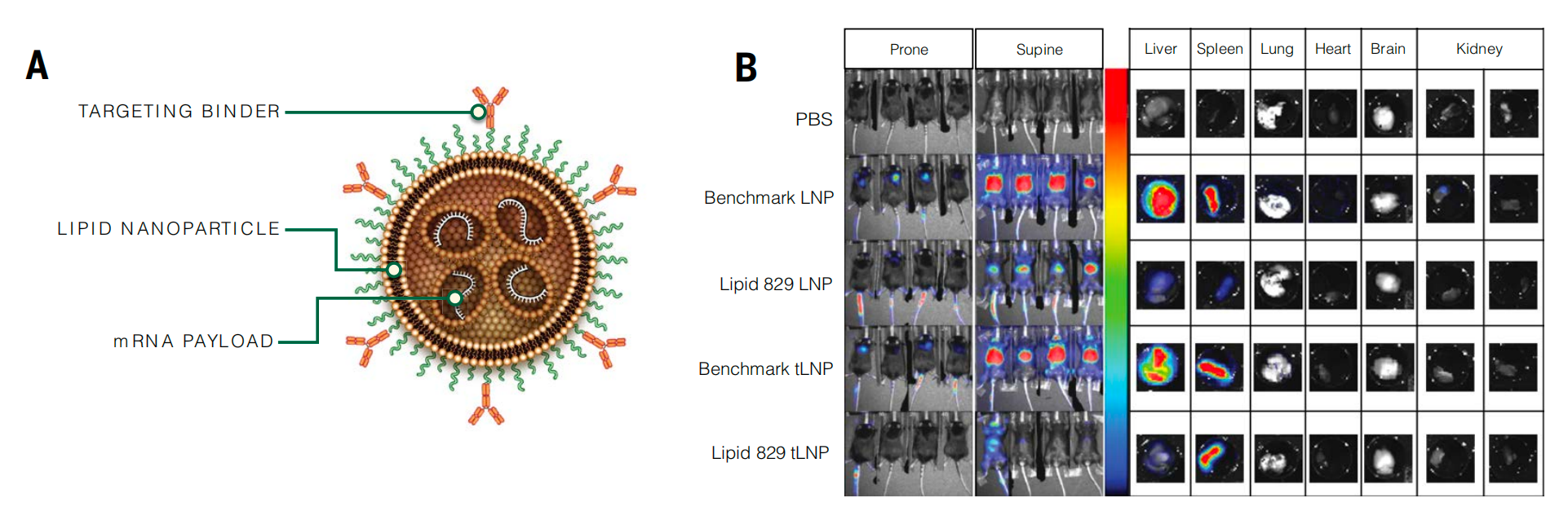
为了进一步评估其体内治疗效果,研究团队将人外周血单个核细胞(PBMC)移植到免疫缺陷小鼠体内,构建了人源化小鼠模型。然后,通过静脉注射 10 毫克或 30 毫克剂量的 CD8-L829-tLNP-CD19,结果显示,1 小时后小鼠脾脏中的 B 细胞开始减少,3 小时后脾脏中的 B 细胞几乎被完全清除,而对照组 tLNP 处理的小鼠则不然。且 CAR 表达主要见于 CD8+ T 细胞,在 CD4+ T 细胞中表达极少。研究团队进一步证实,每 3 天接受一次 30 微克 CD8-L829-tLNP-CD19 注射,共注射 3 次,小鼠在首次注射后长达 14 天内表现出快速且持续的 B 细胞耗竭。
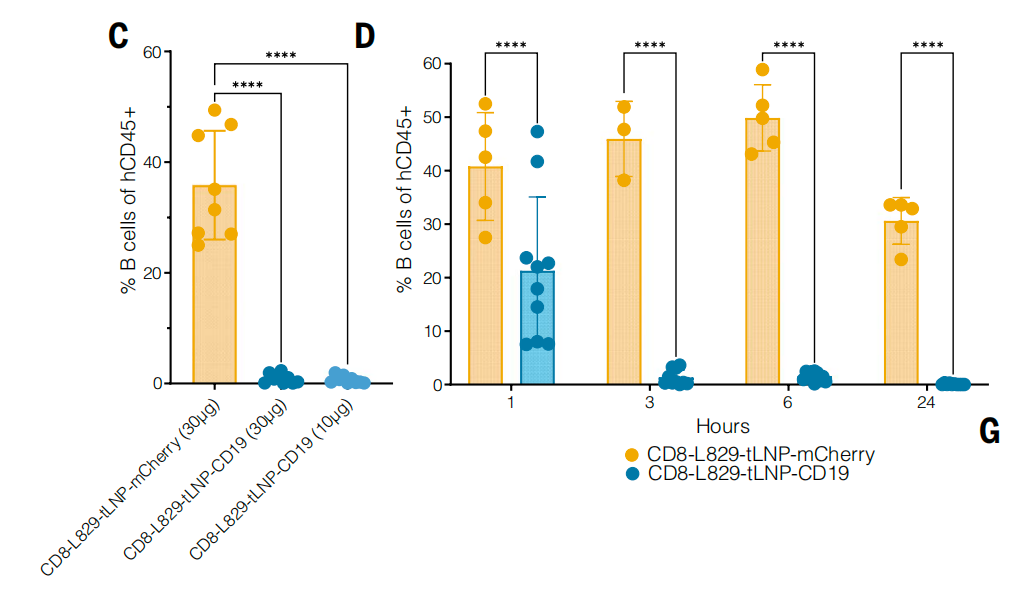
为了验证其在体内的肿瘤治疗效果,研究团队构建例如人源化白血病异种移植小鼠模型,然后,这些小鼠分别接受 10 微克、30 微克的 CD8-L829-tLNP-CD19 治疗或 30 微克的 CD8-L829-tLNP-mCherry 对照治疗,每周 2 次,共 5 次剂量。结果显示,与对照组相比,10 微克剂量对肿瘤控制效果显著,30 微克剂量在首次注射后 2 天内使 5 只小鼠中的 4 只几乎完全清除肿瘤,在第 2 次注射后 3 天内使所有小鼠的肿瘤完全清除。
这些结果表明,CD8-L829-tLNP-CD19 能够在体内有效生成功能性 CAR-T 细胞,且这些 CAR-T 细胞能够清除 B 细胞并消除体内 B 细胞肿瘤,具有治疗癌症和自身免疫疾病的潜在应用价值。
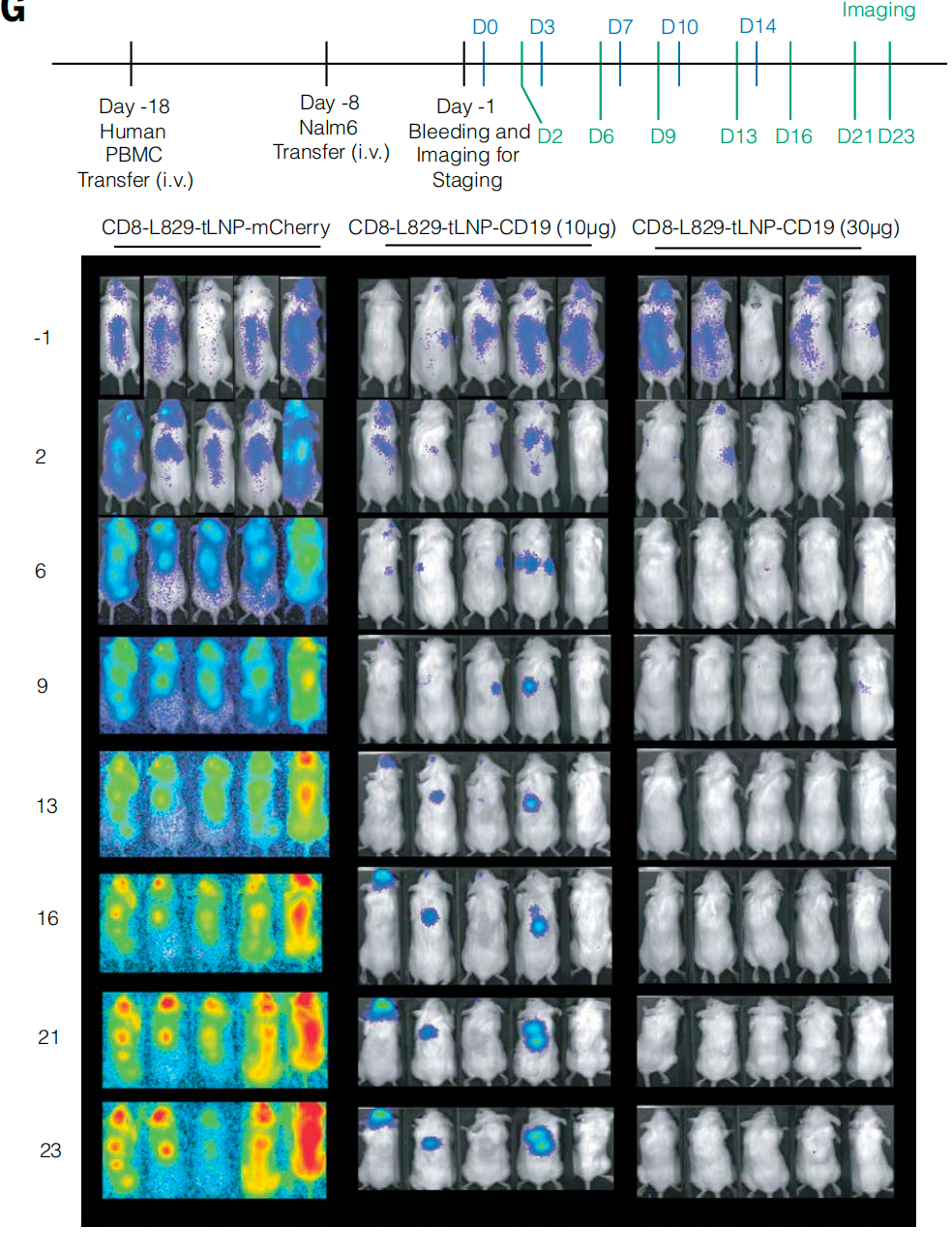
为了评估 in vivo CAR-T 疗法在具有转化相关性动物模型中的有效性和安全性,研究团队在非人灵长类动物模型食蟹猴中进行了研究。但为了靶向食蟹猴的 B 细胞,研究团队使用了 CD20 靶点(而非 CD19),使用 CD8-L829-tLNP 递送经序列优化的 CD20 CAR mRNA。体外实验结果显示,CD8-L829-tLNP-CD20 能够有效改造食蟹猴 T 细胞,使其靶向并清除表达人类或食蟹猴 CD20 的细胞系。
研究团队在 22 只食蟹猴中进行了进一步实验,每隔 72 小时接受一次 CD8-L829-tLNP-CD20 静脉注射,剂量范围为 0.1-2.0 毫克/千克体重,共进行三剂注射。总体而言,该治疗耐受性良好,但在 1.5 毫克/千克体重剂量组中,有 1 只食蟹猴在第三次给药后 72 小时被发现俯卧、活动减少且体温过低,检测显示,其产生了免疫效应细胞相关噬血细胞性淋巴组织细胞增生症样综合征(一种已知的 CAR-T 细胞疗法副作用)。在效果方面,食蟹猴在治疗后观察到血液和组织中 B 细胞的深度和短暂性耗竭,外周血中的 B 细胞在第 21 天开始重新出现,在第 35 天恢复到接近基线的水平,值得注意的是,记忆 B 细胞几乎被完全清除,治疗后重新出现的 B 细胞主要表现为幼稚细胞,这提示了它们的免疫系统已被重置。
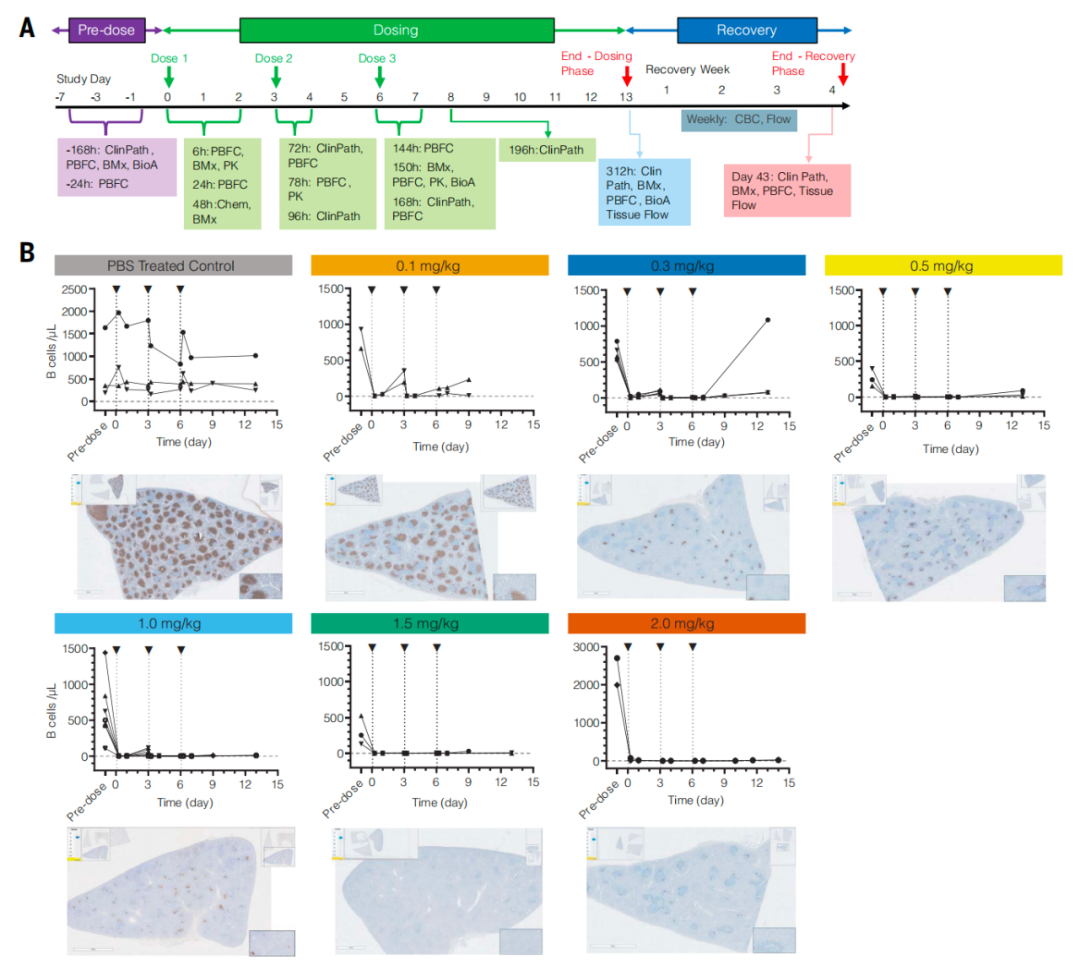
在此基础上,研究团队探索了两剂方案,相比之下,两剂方案效果相当,表现出良好的安全性和耐受性,且避免了第三剂注射后的 IL-6 水平升高等潜在风险。
总的来说,该研究表明,基于 CD8-L829-tLNP 递送 CAR mRNA 的 in vivo CAR-T 技术可在人源化小鼠模型和非人灵长类模型体内优先改造 T 细胞,以快速、深度清除 B 细胞,导致免疫重置,产生持久的治疗益处,从而为 CAR-T 细胞治疗 B 细胞恶性肿瘤及自身免疫疾病提供一种新方案。
论文链接:
1. https://www.science.org/doi/10.1126/science.abm0594
2. https://www.science.org/doi/10.1126/science.ads8473
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


