Nature子刊:光遗传学工具LiSmore助力精准细胞免疫疗法
来源:生物世界 2023-09-13 17:25
综上,光遗传学工具LiSmore的应用可实现蓝光作用下时空特异性地激活STING信号通路,与STING小分子激动剂相比,LiSmore的应用避免了系统性给药带来的STING通路过度激活、泛细胞激活带来
德州农工大学Yun Huang教授与Yubin Zhou教授团队合作,在 Nature Communications 期刊发表了题为:Optogenetic engineering of STING signaling allows remote immunomodulation to enhance cancer immunotherapy 的研究论文。

该研究开发了名为LiSmore(light-inducible SMOC-like repeats)的光遗传学工具。表达LiSmore的树突状细胞(LiSmore-DC)可在蓝光作用下时空特异性地激活STING信号通路,促进DC细胞的成熟及抗原提呈作用,进而激活CD8+T细胞的肿瘤杀伤作用。
LiSmore-DC还可与PD-L1单抗联合,可协同增效对单抗失效肿瘤的抑制作用。此外,蓝光激活的LiSmore-DC具有杀伤远端肿瘤的效应(Abscopal effect),可有效抑制非光照侧的黑色素瘤生长。因此,LiSmore的应用实现了对DC细胞STING通路的时空精准操控,从而实现了安全精准的细胞免疫疗法(图1)。

图1. 光遗传学工具LiSmore的应用可实现蓝光作用下时空特异性地激活STING信号通路,与STING小分子激动剂相比,LiSmore的应用避免了系统性给药带来的STING通路过度激活、泛细胞激活带来的副作用。
LiSmore由CRY2clust与STING蛋白C末端功能域相融合组成(图2),其可响应强度低至0.1mW/cm2的蓝光,研究显示,表达LiSmore的DC细胞可在蓝光照射下特异性激活STING信号通路,上调CD80,CD86,CCR7等激活标志物的表达,促进DC的成熟及抗原提呈作用。LiSmore-DC可激活OT-1 T细胞的活化与增殖,促进其IFNγ的释放,并在体内外模型中增强OT-1 T细胞对B16-OVA细胞的杀伤作用(图3)。
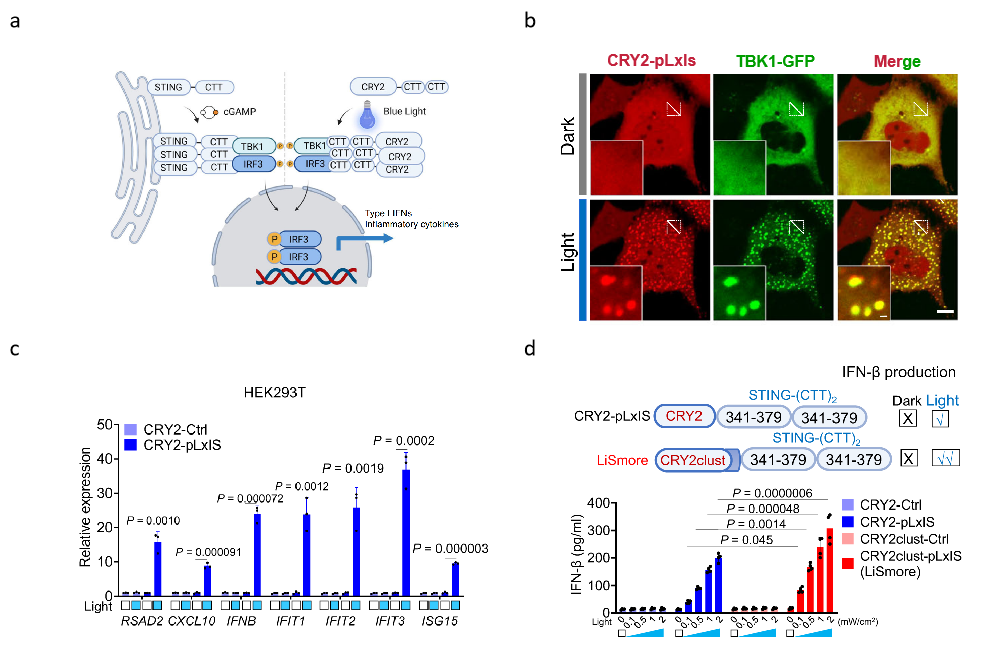
图2. LiSmore构建示意图及功能表征。(a)设计示意图;(b)CRY2-pLxIs在蓝光激活后发生多聚,招募TBK1-GFP, 并激活STING信号通路下游基因(c);(d)与CRY2-pLxIS相比,LiSmore可被强度低至0.1mW/cm2的蓝光激活,促进IFNβ的生成释放
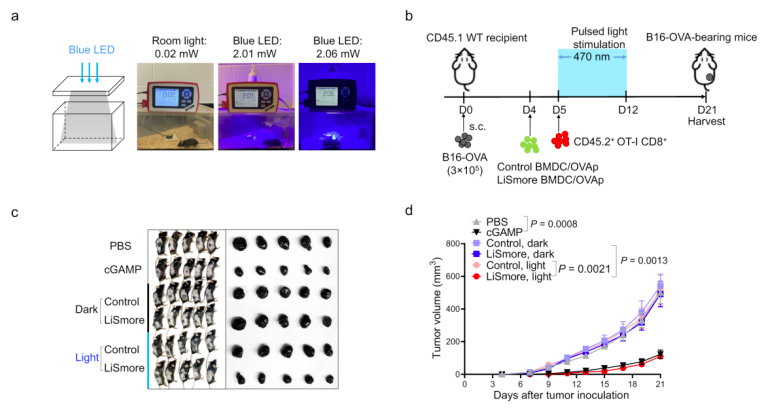
图3. (a)蓝光LED照射荷瘤小鼠;(b)实验设计图;(c,d)蓝光可特异性激活转输至体内的LiSmore-DC,促进其抗原提呈作用,有效的抑制了B16-OVA肿瘤的生长
LiSmore可以与抗PD-L1检查点免疫疗法协同应用,改变肿瘤微环境,使“冷”肿瘤变“热”,协同增效免疫治疗的效果(图3a-b)。除此之外,蓝光激活的LiSmore-DC具有杀伤远端肿瘤的效应(Abscopal effect),可有效抑制非光照侧的黑色素瘤生长(图4c)。
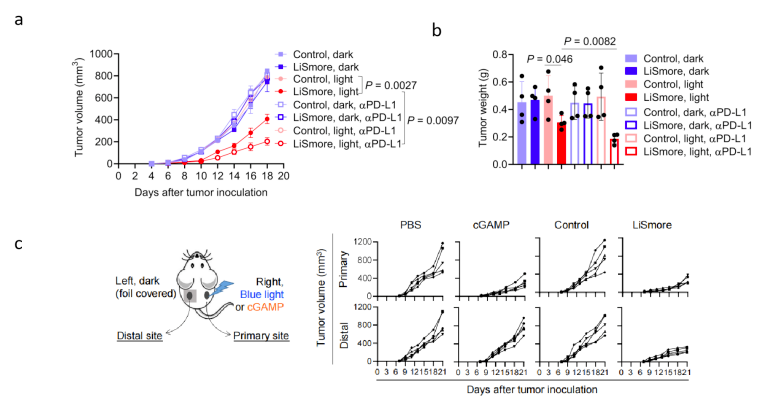
图4. (a-b)蓝光激活LiSmore-DC后,可有效的抑制LL/2-OVA肿瘤生长。PD-L1单抗及蓝光激活LiSmore-DC联合可进一步的抑制LL/2肿瘤生长。(c)蓝光激活的LiSmore-DC可有效抑制光照侧(近端)及非光照侧(远端)的肿瘤生长,而STING激动剂2’3’ cGAMP仅能抑制注射区肿瘤的生长,对远端肿瘤无明显抑制作用。
综上,光遗传学工具LiSmore的应用可实现蓝光作用下时空特异性地激活STING信号通路,与STING小分子激动剂相比,LiSmore的应用避免了系统性给药带来的STING通路过度激活、泛细胞激活带来的副作用。LiSmore DC细胞在蓝光照射后特异性激活,发挥抗原呈递及T细胞激活作用,在体内外模型中显示了显著的肿瘤抑制效果,实现了安全精准的细胞免疫疗法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


