Nat Biotechnol:利用真核逆转录因子蛋白将转基因插入人类安全港位点,有望开发出安全高效的基因疗法
来源:生物谷原创 2024-02-26 09:24
逆转录转座子是 DNA 片段,当转录为 RNA 时,它编码的酶会将 RNA 复制到基因组的 DNA 中——这是一个自我服务的循环,这使得基因组中充斥着逆转录转座子 DNA。
最近,一种治疗镰状细胞病的 CRISPR-Cas9 疗法获得批准,这表明基因编辑工具可以出色地敲除基因来治疗遗传性疾病。但是,将整个基因插入人类基因组以替代有缺陷或有害的基因仍然是不可能的。
一种利用来自鸟类的逆转录转座子(retrotransposon)将基因插入基因组的新技术为基因疗法带来了更多希望,因为它能将基因插入人类基因组的“安全港(safe harbor)”,在那里插入的基因不会破坏基因组中的重要基因,也不会导致癌症。
逆转录转座子是 DNA 片段,当转录为 RNA 时,它编码的酶会将 RNA 复制到基因组的 DNA 中——这是一个自我服务的循环,这使得基因组中充斥着逆转录转座子 DNA。人类基因组中约有 40% 是由这种“自私”的新 DNA 组成的,尽管其中的大部分基因都失去功能,即所谓的垃圾 DNA。
这种新技术被称为“精确 RNA 介导的转基因插入(Precise RNA-mediated INsertion of Transgenes, PRINT)”,它利用某些逆转录转座子的能力,在不影响其他基因组功能的情况下将整个基因有效地插入到基因组中。PRINT 将补充 CRISPR-Cas 技术在让基因失效、制造点突变和插入短 DNA 片段方面的能力。
PRINT是由美国加州大学伯克利分校分子与细胞生物学教授Kathleen Collins实验室开发出的。针对它的描述于2024年2月20日在线发表在Nature Biotechnology期刊上,论文标题为“Harnessing eukaryotic retroelement proteins for transgene insertion into human safe-harbor loci”。

PRINT涉及使用类似于将CRISPR-Cas9送入细胞进行基因组编辑的递送方法,将新的DNA插入细胞。在PRINT中,一段已被递送的RNA编码一种名为R2蛋白的常见逆转录因子,它有多个活性部分,包括缺口酶(nickase)---一种结合和切割双链DNA的酶,以及逆转录酶---一种利用DNA作为模板产生RNA的酶。Collins说,另一种RNA是插入转基因DNA的模板,另外就是基因表达控制元件,这是R2蛋白插入基因组中的整个自主转基因盒。
使用R2蛋白的一个关键优势是,它能将转基因插入基因组中包含数百个相同基因拷贝的区域---每个拷贝都编码核糖体RNA,而核糖体RNA是将信使RNA(mRNA)转化为蛋白的RNA机器。有了这么多的冗余拷贝,当插入的基因破坏了一个或几个核糖体 RNA 基因时,也不会造成不好的影响。
将转基因放入安全港可避免通过人类病毒载体插入转基因时遇到的一个主要问题:基因往往被随机插入基因组,使工作基因失效,或扰乱基因的调控或功能,从而可能导致癌症。
Collins说,“基于CRISPR-Cas9的方法可以修复一个突变核苷酸或插入一小块DNA序列。或者你可以通过位点特异性诱变敲除基因功能。我们不是在敲除基因功能。我们不是在修复内源性基因突变。我们采取的是一种互补的方法,即在基因组中加入一个能自主表达的基因,这个基因能制造一种活性蛋白,这样就可作为一种缺失旁路,重新添加回一个功能基因。这是转基因补充,而不是基因突变逆转。对于修复由同一基因的一系列单个突变引起的功能缺失性疾病来说,这是非常好的方法。”
真正的赢家来自鸟类
许多遗传性疾病,如囊性纤维化和血友病,都是由同一基因的多个不同突变引起的,所有这些突变都会使基因功能丧失。任何基于CRISPR-Cas9的基因编辑疗法都必须根据患者的具体突变情况量身定制。使用PRINT进行基因补充,则可以将正确的基因传递给每位患者,让每位患者的身体都能制造出正常的蛋白,而不管原来的基因突变是什么。
许多学术实验室和初创公司都在研究如何利用转座子和逆转座子插入基因进行基因治疗。生物技术公司正在研究的一种流行的逆转座子是LINE-1(Long INterspersed Element-1),它可在人类中复制自身和一些搭便车的基因,占据整个基因组的大约30%,尽管目前人类基因组中只有不到100个LINE-1逆转座子拷贝具有功能,只占基因组的极小一部分。
Collins与加州大学伯克利分校博士后同事Akanksha Thawani和加州大学伯克利分校分子与细胞生物学系教授Eva Nogales于2023年12月14日在Nature期刊上发表了LINE-1编码的酶蛋白的低温电镜结构(Nature, 2023, doi:10.1038/s41586-023-06933-5)。
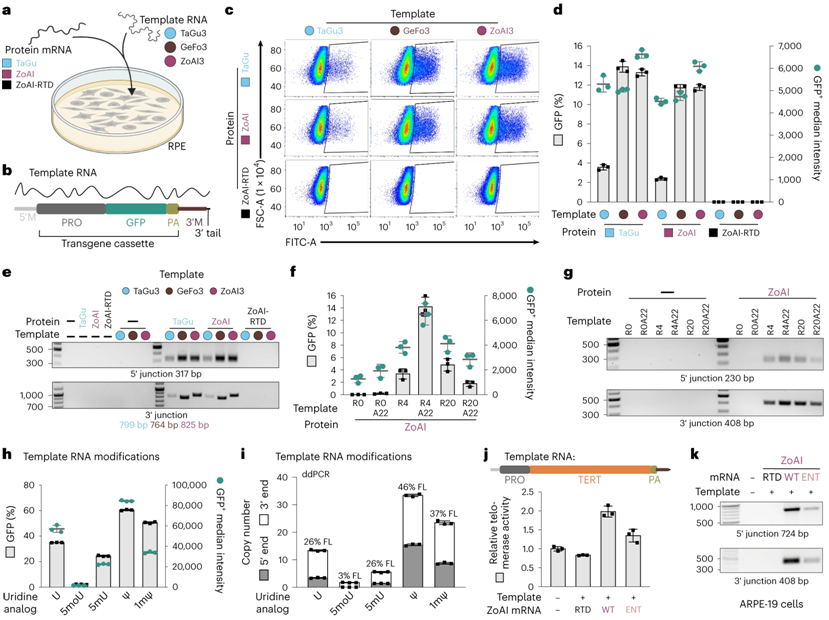
图片来自Nature Biotechnology, 2024, doi:10.1038/s41587-024-02137-y
Collins说,这项新研究清楚地表明,LINE-1逆转录转座子蛋白很难通过基因改造安全有效地将转基因插入人类基因组。不过之前的研究表明,插入基因组中重复的核糖体RNA编码区(rDNA)的基因可以正常表达,这让Collins想到了另一种名为R2的逆转录因子,它可能更适合安全地插入转基因。
由于R2不存在于人类体内,Collins和来自加州大学伯克利分校的高级研究员Xiaozhu Zhang以及博士后研究员Briana Van Treeck筛选了从昆虫到马蹄蟹和其他多细胞真核生物等数十种动物基因组中的R2,以找到一种对人类基因组中的rDNA区域具有高度靶向性,并能高效地将长DNA插入该区域的版本。
Collins说,“在寻找了几十种物种之后,真正的赢家来自鸟类”,包括斑马雀和白喉麻雀。她说,虽然哺乳动物的基因组中没有R2,但它们有R2作为逆转录因子有效插入所需的结合位点---这可能是一个迹象,表明哺乳动物的祖先有一个类似R2的逆转录因子,但不知何故从哺乳动物的基因组中剔除了。
在实验中,Zhang和Van Treeck合成了编码R2蛋白的mRNA和一种模板RNA,这种模板RNA将产生一个携带荧光蛋白的转基因,它的表达由RNA聚合酶启动子控制。它们被共转染到体外培养的人类细胞中。在激光照射下,约有一半的细胞因这种荧光蛋白的表达而亮起绿色或红色,这表明 R2 系统已成功地在基因组中插入了工作荧光蛋白。
进一步的研究表明,转基因确实插入了基因组的 rDNA 区域,而且大约 10 份 RNA 模板可以插入其中而不会破坏 rDNA 基因的蛋白制造活性。
巨大的核糖体生物发生中心
将转基因插入基因组的 rDNA 区域除了能给它们提供安全港外,还有其他好处。rDNA 区域位于五条独立染色体的短臂上。所有这些短臂都挤在一起,形成一个叫做核仁的结构,DNA 在其中转录成核糖体 RNA,然后折叠成制造蛋白的核糖体机器。
在核仁内,rDNA 的转录受到高度调控,其基因也会迅速修复,因为任何 rDNA 断裂如果任其发展,都可能导致蛋白生产停止。因此,任何插入基因组 rDNA 区域的转基因都会在核仁内受到严密保护。
Collins说,“核仁是一个巨大的核糖体生物发生中心。但它也是一个非常优越的DNA修复环境,基因插入的致癌风险很低。这些成功的逆转录因子进入了核糖体DNA,这是非常了不起的。它是多拷贝的,是保守的,是一个安全的港湾,你可以破坏其中的一个拷贝,而细胞并不在意。”这使得该区域成为插入用于人类基因疗法的基因的理想位置。
Collins承认,R2的工作机制还有很多未知之处,rDNA转录的生物学问题也依然存在:有多少个 rDNA 基因会在细胞关注之前被打乱?由于有些细胞会关闭人类基因组中 400 多个 rDNA 基因中的许多基因,这些细胞是否更容易受到 PRINT 副作用的影响?
她和她的团队正在研究这些问题,同时也在调整参与逆转录因子插入的多种蛋白和 RNA,以使 PRINT 在体外培养的细胞和来自人体组织的原代细胞中发挥更好的作用。
不过,她说,底线是“它能起作用。只是我们必须对 rDNA 的生物学特性有更多的了解,才能真正利用它”。(生物谷 Bioon.com)
参考资料:
Xiaozhu Zhang et al. Harnessing eukaryotic retroelement proteins for transgene insertion into human safe-harbor loci. Nature Biotechnology, 2024, doi:10.1038/s41587-024-02137-y.
Junk DNA in birds may hold key to safe, efficient gene therapy
https://phys.org/news/2024-02-junk-dna-birds-key-safe.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


