全球15款上市ADC药物技术透视及未来创新方向
来源:医药魔方 2023-01-17 17:27
抗体偶联药物,也称抗体药物偶联物(Antibody-drug conjugates),简称ADC。ADC是双靶点药物,由抗体、payload、linker三部分构成,抗体决定所治疾病类型
抗体偶联药物,也称抗体药物偶联物(Antibody-drug conjugates),简称ADC。ADC是双靶点药物,由抗体、payload、linker三部分构成,抗体决定所治疾病类型,payload决定如何治疗,linker决定payload与抗体的连接方式和释放方式。

ADC药物的概念,在1913年由Paul Ehrlich首次提出。历经87年的研究探索,2000年首个ADC药物Mylotarg上市。随着对payload linker研究的逐步深入,近年来ADC技术获得诸多新的重大突破。2020年前后,ADC产品的上市迎来爆发期,连续11个ADC品种获批上市,其中Enhertu和Trodelvy突破了传统ADC的概念和技术瓶颈,大幅提升了ADC治疗效果,在低表达、对传统治疗耐药的实体瘤中也展现出效果,有望进入一线治疗,成为重磅级产品几乎是没有悬念,引领了ADC领域的发展方向。
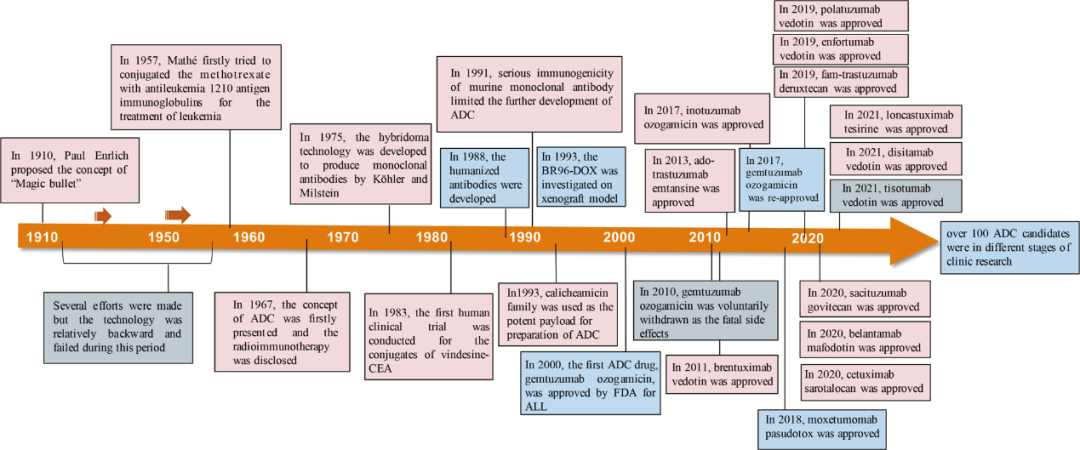
ADC历史沿革
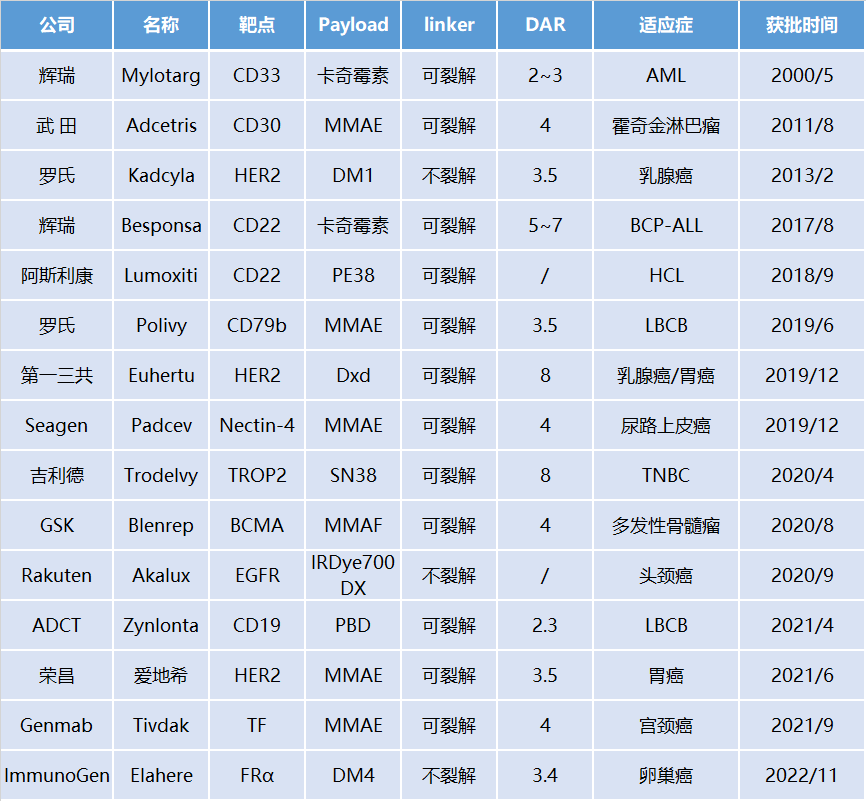
全球15款上市ADC药物技术透视
截止到2023年1月13日,全球共有15款ADC药物获监管部门批准上市,其中13款为传统小分子payload linker。在这13款产品中,毒素方面,MMAE/MMAF类有6款,喜树碱类、卡奇霉素类、Maytansine类各有2款,PBD类1款;linker方面,采用可裂解linker的有10款,不可裂解linker的3款;偶联位点方面,通过抗体半胱氨酸偶联的有9款,赖氨酸偶联的4款。
全球已批准上市的ADC药物
ADC技术的发展历程可大致分为4个阶段:
-
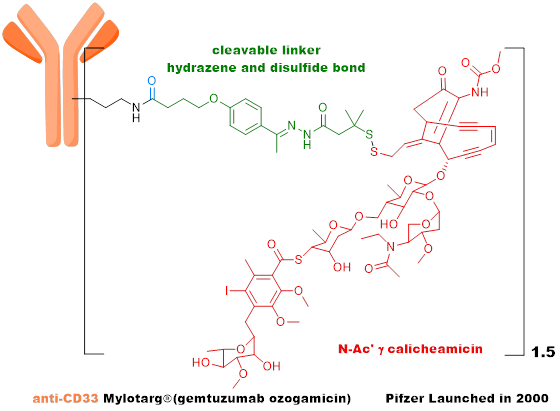
第一代ADC采用鼠源抗体+高活性payload+不稳定linker+随机偶联策略,免疫原性高,为不同DAR值组分的混合物,代谢不稳定,安全窗窄,成药挑战较高,代表性品种为Mylotarg。
-
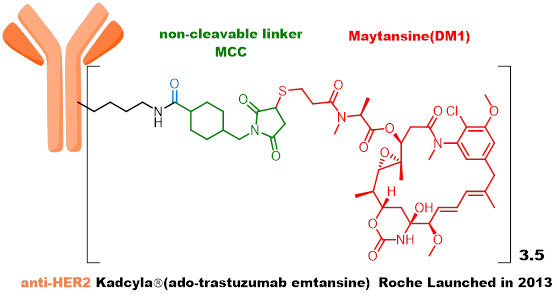
第二代ADC采用人源化抗体+高活性payload+稳定linker+随机偶联策略,免疫原性低,代谢稳定性大幅提高,治疗指数提高,代表性品种为Kadcyla和Adcetris。
-
第三代ADC为定点定量偶联技术,采用低DAR值、高活性payload的策略,代谢稳定性、均一性好,初步临床表现喜人,仍待进一步验证,代表性品种ARX788和四川科伦的A166。
-
第四代ADC技术采用高DAR值(4-8)、中低活性payload策略,payload具有较高的旁观者效应,最重要的特点是对肿瘤表面抗原低表达和高表达抗原肿瘤都具有很好的疗效,代表性品种为Enhertu、Trodelvy和四川科伦的SKB264。
第一代ADC属于早期探索阶段,对payload活性、linker性质、payload释放方式等关键问题的认识基本空白。Mylotarg于2000年5月获美国FDA批准上市,用于治疗急性髓系白血病。但不幸的是,Mylotarg与化疗相结合并未表现出比单独化疗更高的生存率,而致死率更高,于2010年撤市。Mylotarg的payload采用卡奇霉素,linker是含腙键和二硫键的化合物。该类payload的效力不足,对肿瘤细胞的杀伤作用有限。linker的作用是将抗体和payload偶联,既要保证ADC在循环过程中稳定,又要确保ADC达到靶组织后,payload快速释放。而实际情况是,Mylotarg的linker代谢稳定性不佳,在尚未达到靶组织时,payload就过早地释放了,引发了强烈的肝毒性。
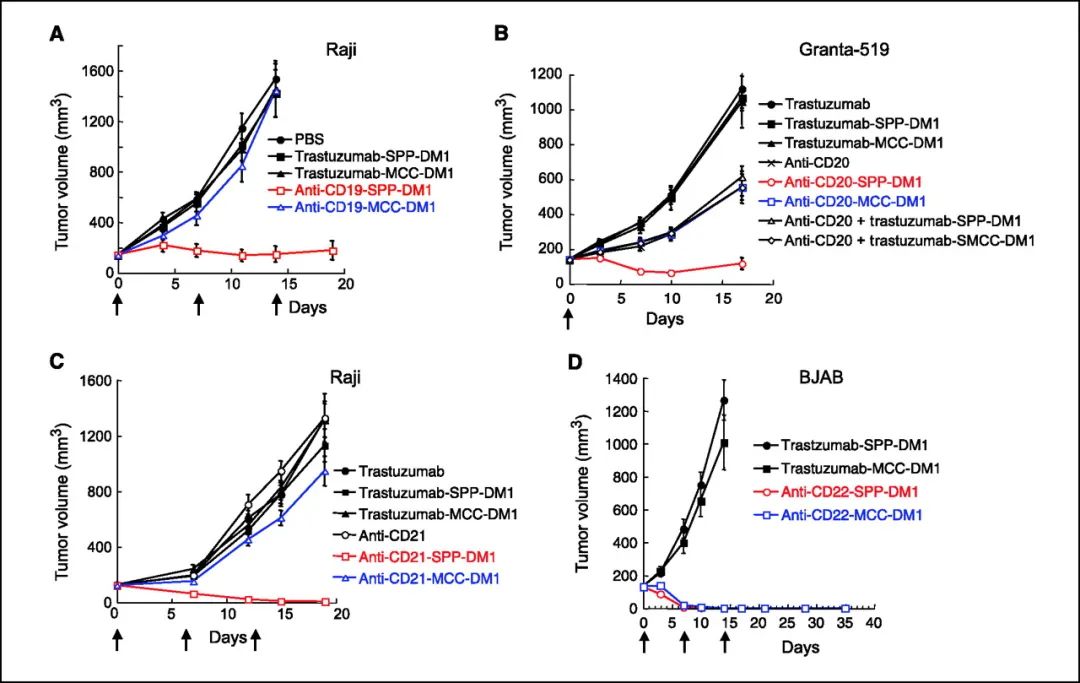
第二代ADC丰富了linker类型,不仅开发了利用组织蛋白酶B裂解的肽类linker和不可裂解linker;也开发了更多的偶联位点,包括半胱氨酸的巯基和赖氨酸的氨基。2013年2月获得FDA批准上市的Kadcyla由Roche开发,技术源于ImmunoGen,既是全球首个靶向HER2的ADC,也是全球首个针对实体瘤获批的ADC。其采用的payload是DM1,linker为不可裂解,通过氨基与抗体连接。Adcetris由Seagen(原Seattle Genetics)开发,payload为MMAE,linker为VC linker,通过巯基与抗体连接。该payload linker后命名为vedotin,共计产生了5个上市的ADC产品,是目前为止最为成功也是使用最广泛的payload linker。
与第一代ADC相比,二代ADC显示出良好的临床疗效和安全性。第二代ADC的payload linker具有如下三个共同特征:一是异质性,payload linker具有较强的疏水性,随着DAR增加,ADC体外活性也随之增加,但由于抗体性质受偶联物影响,清除率和聚集率也增加,体内活性不增反降;二是循环稳定差异性,无论是可裂解或不可裂解linker,payload linker和抗体上不同氨基酸残基形成的化学键在系统中的稳定性不同,导致payload容易在系统循环中从ADC上脱落,产生较高的系统毒性;三是CMC难度大,由于不同连接位点产生毒素脱落的速度和程度不同,因此CMC控制需要非常严格。
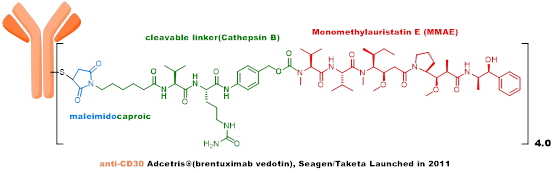
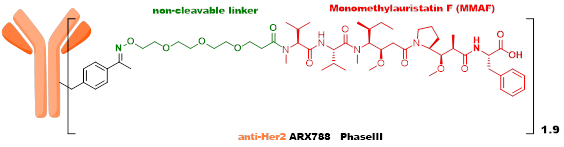
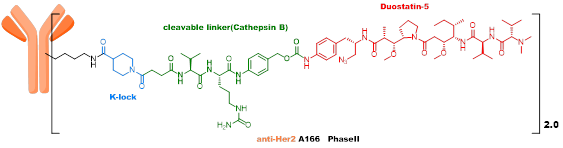
第三代ADC,吸取了早期ADC的经验——不均一性、不稳定性是影响ADC体内药效和毒性重要因素,高DAR值组分在体内稳定性差,影响ADC治疗窗口,所以采用了定点偶联及低DAR值的策略。ARX788由Ambrx开发,目前在临床III期,采用的毒素是MMAF类似物,linker为不可裂解,通过抗体上的非天然氨基酸进行偶联。A166由四川科伦开发,目前在临床II期,采用的毒素也是MMAF类似物,linker为VC linker,通过K-Lock技术与抗体连接。
这一代ADC的payload linker采用的是新一代定点偶联技术,ADC均一度高、稳定性好,代表性技术包括:1)工程化半胱氨酸;2)非天然氨基酸;3)酶催化偶联;4)糖基偶联;5)特殊偶联接头。由于DAR值较低,payload倾向于活性更强的毒素分子(如PBD、Tubulysin等)。
通过对已有产品的分析,我们发现定点偶联不是影响ADC毒性的关键,定点偶联得到的产物是否具有更好稳定性才是核心。
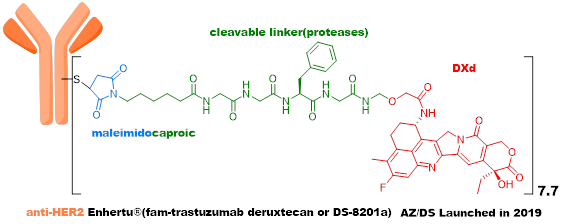
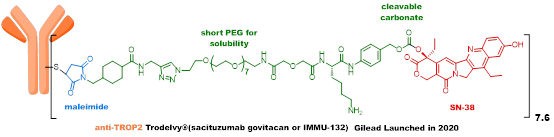
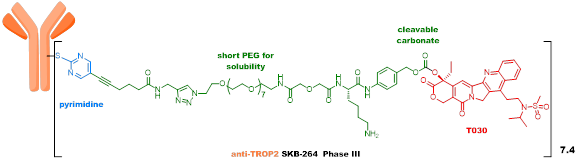
第四代ADC,有代表性的三个品种(Enhertu、Trodelvy和SKB264)疗效显著,未来拥有巨大的想象空间。Enhertu重新定义了乳腺癌的治疗方式,正在冲击一线疗法;Trodelvy是首个针对三阴性乳腺癌的ADC药物,并取得了210亿美元的交易额;SKB264临床效果确切,相关技术平台实现了与MNC的巨额交易。
分析上述三个产品,payload作用机制新颖,linker方面也做了极大的更新。Payload全部采用了喜树碱类拓扑异构酶I抑制剂,具有以下四个特点:①靶向DNA,靶点“浓度”低;②毒性低,血浆清除率高,系统毒性相对较低;③高渗透性,具有很好的旁观者效应;④对微管蛋白抑制剂耐药的肿瘤有效。
Linker方面,Enhertu采用了新颖的四肽(GGFG)+自裂解片段+马来酰亚胺接头,GGFG可被多种组织蛋白酶(Cathepsin)裂解,新的自裂解片段也是第一三共首次开发,偶联采用了常规的马来酰亚胺接头,其会在体循环中脱落,导致系统毒性。
Trodelvy采用了首创的“自裂解”linker,其在纯水、血液、肿瘤微环境中都可以释放毒素,因此不需要细胞内吞就可以实现抗肿瘤效果,但由于其采用的payload活性较弱,同时在体循环中稳定性较差,导致疗效尚有较大的提升空间,适应证无法进一步拓展。
SKB264采用了创新的嘧啶偶联接头,相较马来酰亚胺接头,代谢稳定性得到极大提升,同时payload采用活性较强的新的喜树碱类化合物。SKB264通过对整体和局部ADC分子的理化性质调控,提高了ADC分子的化学稳定性,其在纯水和血浆中的半衰期较Trodelvy大幅提高,临床前动物模型上药效也显著优于Trodelvy,治疗指数显著提高。SKB264目前处于临床III期。SKB264的payload linker技术,从已有的专利看,具备应用于多种肿瘤治疗的潜力。
新一代ADC不足之处
虽然以Enhertu为代表的新一代ADC取得了巨大成功,但仍有较大的改进空间。
-
从payload来看,作用机制相对单一(微管蛋白、DNA),以细胞毒类化合物为主,选择比较少,且常常引起耐药。
-
从linker来看,传统ADC需要通过肿瘤细胞内吞,溶酶体裂解等过程,很多的环节可以造成ADC耐药或完全没有治疗效果,并且传统内吞机制ADC对靶抗原高表达的Her2 ADC效果较好,但对靶抗原低表达的其它靶点ADC治疗效果相对较差;linker在循环系统中稳定性不足,容易引起系统毒性反应。
-
从ADC来看,分子量大,肿瘤富集速度慢,渗透率低,且传统技术要求抗体能够内吞才能起效,非内吞抗体无法用于ADC的开发,使得抗体选择有限。
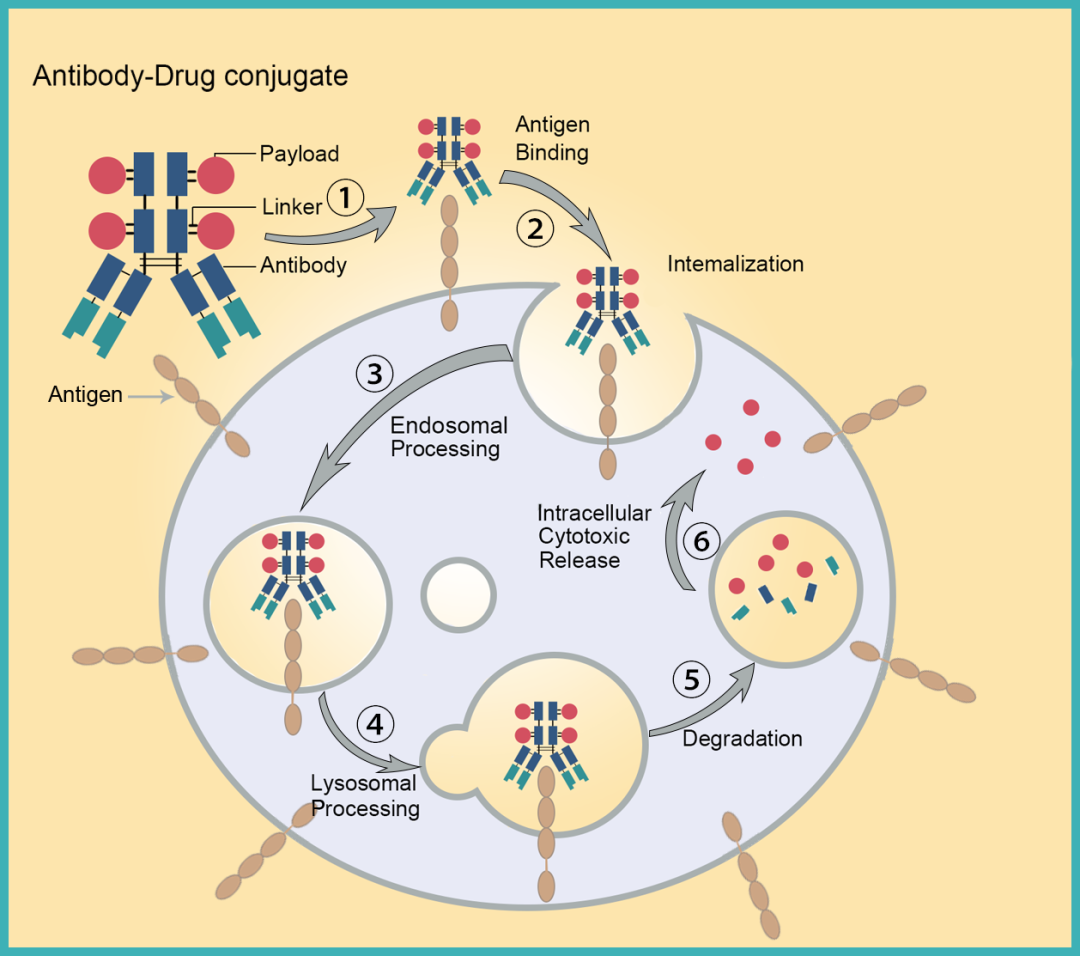
传统ADC起效机制
下一代ADC创新方向
关于下一代ADC创新方向,总的来说,就是以现有ADC技术的缺点为切入点,通过对payload和linker的进一步优化,通过增强ADC稳定性、提高毒素“利用率”、拓展新毒素等途径,增加ADC疗效,克服耐药性。
从payload新作用机制角度进行探索。即以临床需求为导向,payload由细胞毒药物转向其他靶点。比如以下几个方向:
-
一是肿瘤免疫激动剂,涉及到的靶点有TLR、STING等。因该类分子可能激活全身非特异性免疫反应,严重时发生细胞因子风暴危及生命,单独小分子比较难成药。作为ADC的payload,与抗体偶联形成ISAC,既能激活固有免疫,又能介导获得性免疫,实现将“冷肿瘤”变为“热肿瘤”发挥更强的免疫作用。Bolt、Silverback、Tallac、Takeda、Mersana、Seagen、恒瑞、启德、加科思等众多企业已经介入到以TLR激动剂、STING激动剂为payload的ADC的研究中。TLR类ADC最高进展至临床I期,目前还没有看到实质性进展;STING类ADC目前还处于临床前阶段,ADC能否克服STING小分子临床存在的有效性问题,非常值得期待。
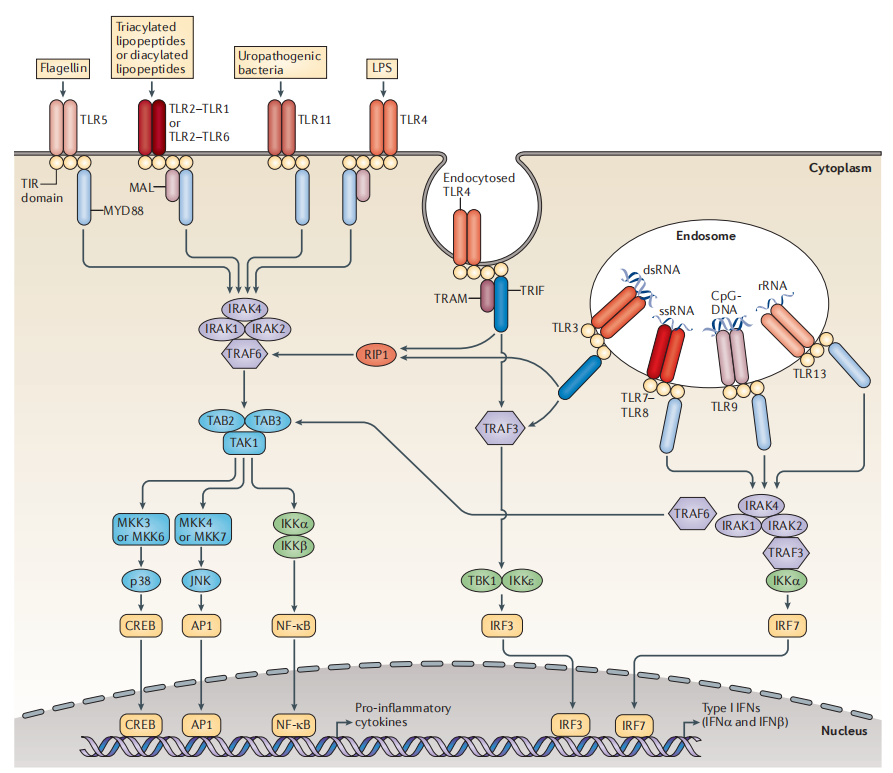
TLR免疫激动剂信号通路
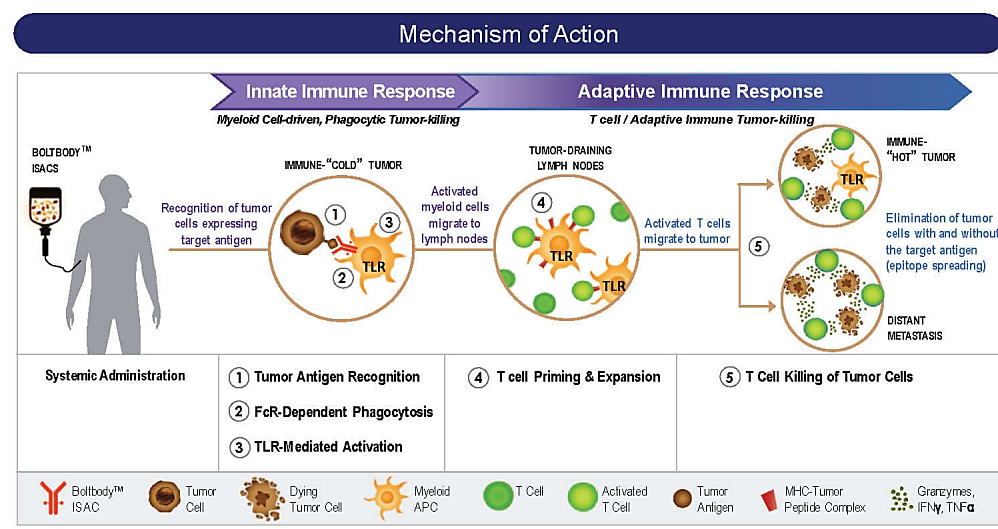
MOA of TLR ADC(来源:Bolt Biotherapeutics)
-
二是蛋白降解剂,包括PROTAC和分子胶。从作用机理上看,该类分子有一个最大的特点,就是“催化量”即可产生较强的药效。PROTAC分子,包含E3泛素连接酶配体、靶蛋白配体以及将两者连接在一起的连接体,分子量大(通常在700-1000Da),所以DMPK特性较差,清除率高、口服生物利用度低,单独成药难度大。分子胶,分子量小,通常药代性质较好,但靶点选择性较差,往往带来较大毒性,临床剂量很低,适应证受限。将蛋白降解剂偶联形成ADC,恰好可以“扬长避短”。
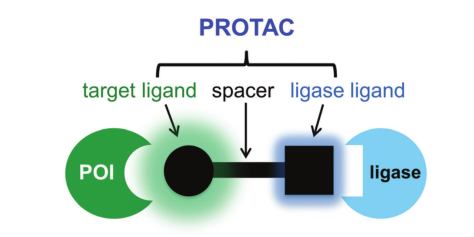
PROTAC结构示意图
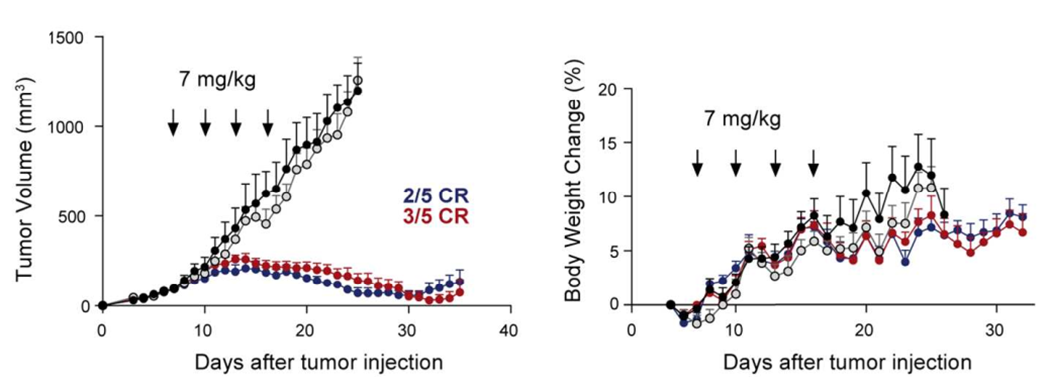
Orum Therapeutics开发了TPD2技术平台,首个产品以GSPT1分子胶为payload,得到Her2靶向的ADC分子ORM-5029,现已进入临床I期。在体外活性测试中,ORM-5029对多种细胞显示出强大的杀伤活性,优于Enhertu。在体内活性测试中,在乳腺癌细胞模型(MDA-MB-453和HCC1569)上表现出高效持续的肿瘤生长抑制活性,在10mg/kg剂量下已出现肿瘤消退。
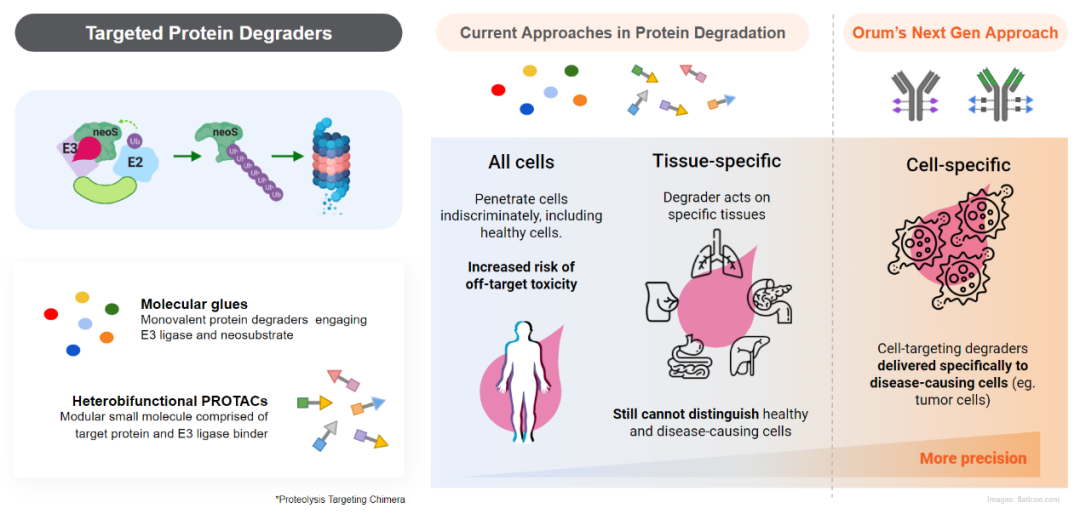
TPD2技术(来源:Orum官网)
其他payload还涉及核酸类化合物、放射性核素、糖皮质激素、抗生素和一些创新药物(例如凋亡诱导剂、烟酰胺磷酸核糖转移酶抑制剂、蛋白酶抑制剂等)。
新靶点payload的ADC尚处于早期阶段,需要大量的研究支持概念验证。同时,新型payload大多为非强效的细胞毒类药物,确保payload能够在靶组织达到最低有效浓度是主要挑战。
从新型linker角度展开探索。现有linker的主要作用是将payload与抗体连接,同时在靶组织释放payload,且体循环稳定性还需进一步提升。除此之外,新型linker还需赋予更多的功能,比如可以从以下三个方向着手:
一是开发胞内(溶酶体)、胞外(肿瘤微环境)都能有效释放payload的linker,从而显著提高payload“利用率”。这将不仅解决ADC渗透率低的问题,也可扩大应用于ADC的抗体选择范围。换句话说,内吞弱、不内吞的抗体都可用于ADC开发,肿瘤细胞外的靶点也可开发ADC。
有报道称Val-Cit-PABC以及Val-Ala-PABC连接子除了可以被胞内溶酶体Cathepsin B水解外,还可以通过“胞外酶解”有效释放毒素达到肿瘤杀伤效果。但由于VC连接子在小鼠血浆中不够稳定,其体内药效是源自肿瘤微环境裂解,还是在血液循环中裂解仍然存在争议。此外,传统VC连接子技术由于理化性质原因用于高DAR值ADC需要进一步修饰。
Val-Cit-PABC以及Val-Ala-PABC连接子可胞外裂解
谷胱甘肽可以有效裂解双硫键,肿瘤组织中谷胱甘肽浓度是血液中的1000倍,可以在肿瘤中选择性地裂解双硫键连接子,释放毒素,达到体内抗肿瘤效果。SPP连接子具备这一特性,对于能够内吞和不能内吞的抗体组成的ADC都具有体内药效。
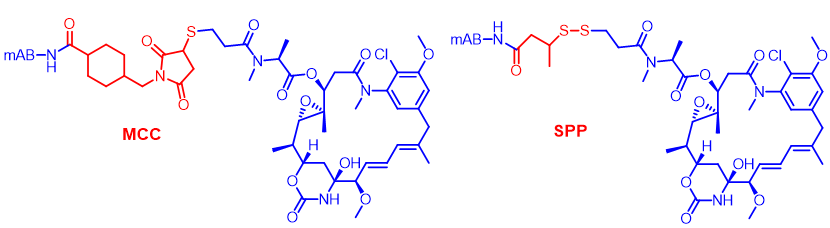
SPP连接子的胞外裂解
β-葡萄糖醛酸苷酶在肿瘤组织(胞外和胞内)高表达,被用来进行ADC药物研究,Seagen等开发了相关linker技术。
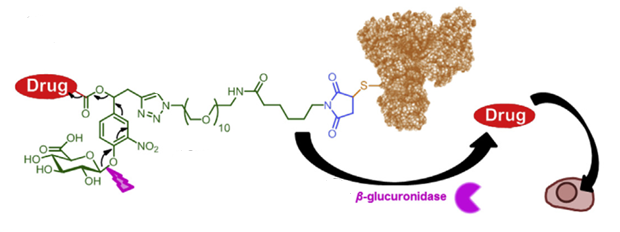
基于β-葡萄糖醛酸苷酶的payload linker
其它肿瘤高表达蛋白水解酶包括MMP-2,MMP-9, 天冬氨酸蛋白内切酶(legumain)等,也可在肿瘤微环境释放payload。
二是通过被动靶向途径,通过linker进一步增强ADC的肿瘤组织靶向性。目前鲜有文献报道。
三是优化payload linker理化性质、增加payload溶解度、提升ADC代谢稳定性、提高偶联及payload释放的效率和速度。
Synaffix开发的HydraSpace™技术是一种具有高极性的linker,可显著提升分子亲水性。
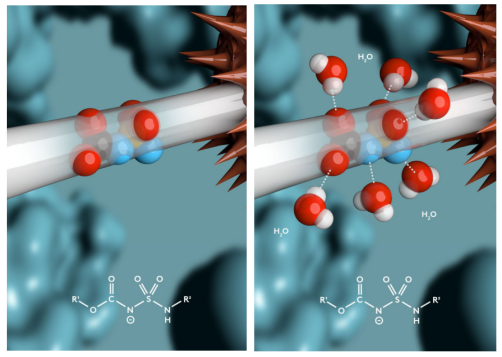
HydraSpace™技术(来源:Synaffix官网)
Mablink的PSARlink™技术平台,在linker上增加了一个基于内源性肌氨酸的多肽,能够显著改善ADC的药学性质,即使当DAR值为8时,也能保持天然抗体的药代动力学特性。
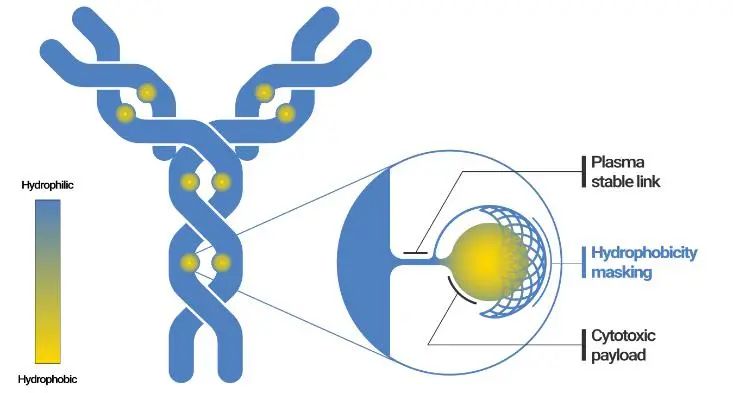
PSARlink技术(来源:Mablink官网)
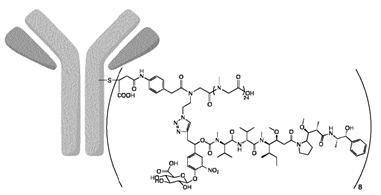
PHF高分子(Mersana开发)、PEG也是增强payload linker溶解度的手段。
苏州宜联生物开发的TMALIN™技术平台,兼具高体内循环稳定性、可以利用肿瘤微环境和传统溶酶体进行胞外胞内双重裂解、高水溶性、能够主动进行肿瘤组织富集等多个新功能,以之形成的ADC产品正在进行临床验证。
结语
笔者看来,未来的ADC需要更多不同机理payload解决药物耐药性问题,需要肿瘤微环境裂解linker解决ADC过程耐药性问题。相信在未来五年,将有更多更好的ADC产品上市,惠及广大患者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


