Nature:新研究揭示噬菌体在多溶原性时的命运决定机制
来源:生物谷原创 2023-08-21 10:44
病毒就像电影中的反派一样,有两种活动方式:冷却或杀戮(chill or kill)。它们可以低调行事,悄无声息地渗入身体的防御系统,也可以发动攻击,从藏身之处爆发出来,向四面八方开火。病毒攻击几乎都是
病毒就像电影中的反派一样,有两种活动方式:冷却或杀戮(chill or kill)。它们可以低调行事,悄无声息地渗入身体的防御系统,也可以发动攻击,从藏身之处爆发出来,向四面八方开火。病毒攻击几乎都是自杀性的,会撕裂病毒赖以生存的细胞。只有周围有足够多的健康细胞可以被感染,这种攻击才能成功。如果病毒颗粒的攻击一无所获,病毒就无法继续生存。它不会死,因为严格来说病毒不是活的,但它停止了发挥功能。因此,对于病毒来说,关键的挑战在于决定何时从冷却模式进入杀戮模式。
四年前,美国普林斯顿大学生物学家Bonnie Bassler和她当时的研究生Justin Silpe发现一种病毒有一个关键优势:它可以窃听细菌之间的交流。具体来说,它可以窃听细菌细胞在达到临界数量时释放的“我们有法定数量!”化学物。这种细菌交流过程被称为群体感应(quorum sensing),它的最初发现为Bassler和她的同事们带来了一系列奖项。

如今,Bassler、Silpe和他们的研究同事们在一项新的研究中发现,数十种病毒会对来自细菌的群体感应或其他化学信号做出反应。相关研究结果于2023年7月26日在线发表在Nature期刊上,论文标题为“Small protein modules dictate prophage fates during polylysogeny”。
Bassler说,“世界上有很多病毒都能监测到适当的宿主信息。我们不知道所有的刺激因素是什么,不过我们在这篇论文中发现这是一种常见的机制。”
他们不仅证实了这一策略的丰富性,还发现了控制这一策略以及发出信号告诉病毒从冷却模式转变为杀戮模式的信号的工具。
这种攻击细菌细胞的病毒被称为噬菌体(bacteriophage)会停留在细菌细胞表面,并将其基因传递到细菌细胞中。不止一种噬菌体可以同时感染一种细菌,只要它们都处于冷却模式,生物学家称之为溶原性(lysogeny)。当多个噬菌体在单个细菌中进行冷却时,就称为多溶原性(polylysogeny)。
在多溶原性下,多个噬菌体可以共存,让细菌细胞像健康细胞一样一遍又一遍地自我复制,病毒 DNA 或 RNA 隐藏在细菌自身的 DNA 或 RNA 中,与细胞一起复制。但这些渗透的噬菌体并不完全是和平的,更像是相互确保的毁灭。这种微妙的缓和关系一直持续到有什么东西触发一个或多个噬菌体进入杀戮模式。
研究噬菌体战争的科学家们早就知道,对系统的重大破坏---比如大剂量紫外线辐射、致癌化学物质,甚至一些化疗药物---会让所有常驻噬菌体进入杀戮模式。科学家们认为,此时噬菌体会开始冲刺,争夺细菌的资源,速度最快的噬菌体将赢得胜利,释放出自己的病毒颗粒。
但Bassler团队发现并非如此。Bassler团队博士后助理研究员Grace Johnson利用高分辨率成像技术观察了感染了两种噬菌体的单个细菌细胞,并向它们注入了一种通用杀伤信号。这两种噬菌体都开始行动,撕碎宿主细胞。为了观察结果,Johnson在每种噬菌体的基因上“涂抹”了特殊的荧光标签,这些标签会根据哪种噬菌体正在复制而发出不同颜色的光。
当荧光标签亮起时,她震惊地发现并没有明显的赢家。两者之间甚至没有平分秋色。相反,她看到一些细菌发出一种颜色的光,另一些细菌发出第二种颜色的光,还有一些细菌是混合体---同时产生两种噬菌体。Bassler说,“没有人想到会有三个亚群。那真是激动人心的一天。我可以看到这些不同的细菌细胞在进行所有可能的噬菌体生产组合---诱导其中一种噬菌体、诱导另一种噬菌体、同时诱导两种噬菌体。有些细胞没有诱导任何一种噬菌体。”
另一个挑战是找到一种方法,一次只诱导两种噬菌体中的一种。Silpe率先找到了触发因子。虽然Bassler团队还不知道这些噬菌体在自然界中会对什么信号做出反应,但Silpe已为每种噬菌体设计了一种特定的人工化学触发因子。Bassler团队博士后Grace Beggs在这种人工系统的分子分析中发挥了重要作用。
当Silpe将多溶原性的细菌细胞暴露在他的人工化学触发因子下时,只有对这种触发因子做出反应的噬菌体才会复制,而且是在所有细菌细胞中复制。其他噬菌体则完全处于冷却状态。
他说,“我没想到会成功。我预计,由于我的策略没有模拟自然界中的真实过程,两种噬菌体都会复制。没想到我们只看到了一种噬菌体会复制。据我所知,以前从未有人这样做过。”
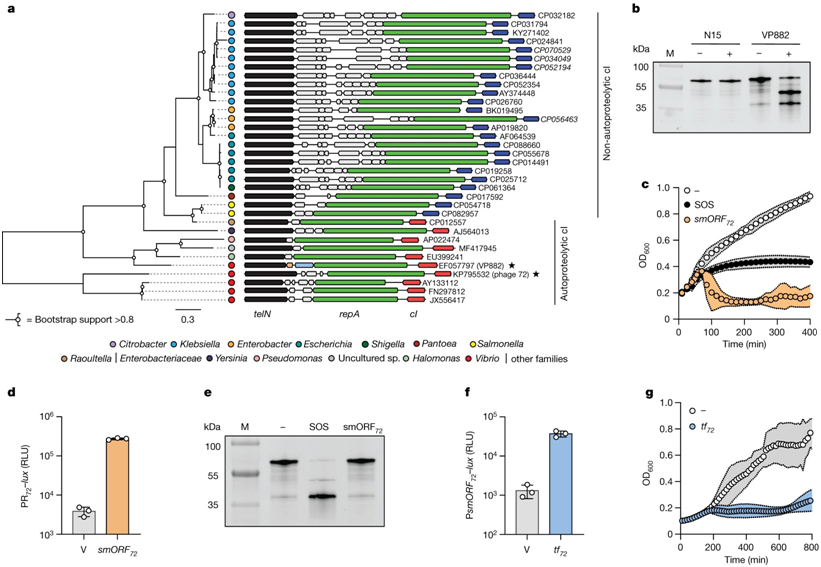
线性质粒样噬菌体中其他保守位点的可变基因含量表明,TF-smORF模块调节裂解,这种调节与SOS无关。图片来自Nature, 2023, doi:10.1038/s41586-023-06376-y。
Bassler说,“我认为,在Johnson和Silpe做实验之前,没有人想过要知道噬菌体-噬菌体战争是如何在单细胞中发生的,因为他们认为这是不可能做到的。细菌非常微小。即使是单个细菌也很难成像,而要成像细菌内部的噬菌体基因真地非常非常困难。”
Johnson一直在调整成像平台---荧光原位杂交(fluorescence in situ hybridization, FISH)---用于另一个涉及生物膜(biofilm)的群体感应项目,但当她在一次小组会议上听到Silpe分享他的研究时,她意识到FISH可以揭示到目前为止关于窃听噬菌体的棘手秘密。
Bassler 说,世界上大多数细菌体内都有不止一种噬菌体,“但没有人能够像这两种噬菌体那样对它们进行操纵和成像。”“他们可以根据需要诱导一种噬菌体、另一种噬菌体或两种噬菌体(这种灵巧的策略是Justin的杰作),然后还能在单个细菌细胞中看到实际发生的情况?这也是从未有过的。我们可以在单细胞水平上看到噬菌体战争。”
Bassler补充说,“噬菌体基因组上的几乎所有基因仍然是神秘的。我们根本不知道大多数病毒基因是做什么的。”
她说,“是的,在这项新的研究中,我们发现了一些噬菌体基因的功能,我们证明了它们的作用就是启用这种完全出乎意料的冷却-杀戮开关,而这个开关决定了在噬菌体-噬菌体战争中哪种噬菌体会获胜。这一发现表明,还有更多令人兴奋的过程有待发现。噬菌体在 70 年前开创了分子生物学时代,如今它们又开始流行起来,既可以作为治疗手段,也可以作为在进化过程中使用过的令人难以置信的分子技巧的宝库。这是一个宝库,而且几乎完全未被开发。”(生物谷 Bioon.com)
参考资料:
Justin E. Silpe et al. Small protein modules dictate prophage fates during polylysogeny. Nature, 2023, doi:10.1038/s41586-023-06376-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


