PNAS:利用低温电子断层扫描成功对突触小泡进行三维成像
来源:生物谷原创 2024-12-31 13:31
V-ATPase和突触素之间的相互作用为一些神经系统疾病的分子机制提供了见解。
在一项新的研究中,德国马克斯-德布吕克分子医学中心原位结构生物学实验室组长Misha Kudryashev教授及其同事们揭示了突触小泡(synaptic vesicle, SV)分子结构的新特征。通过低温电子断层扫描(cryo-electron tomography),他们能够三维可视化观察SV,并确认潜在的重要蛋白相互作用。他们还拓宽了人们对SV的功能和如何循环利用SV的理解。
相关研究结果近期发表在PNAS期刊上,论文标题为“Molecular architecture of synaptic vesicles”。

Kudryashev说:“SV在大脑的功能中至关重要,科学家们几十年来一直在研究它们。然而,之前的报告描述了‘平均’突触小泡的分子组成。我们的研究能够以分子分辨率对单个SV进行成像。”
SV是储存和释放多巴胺和血清素等神经递质的球形结构,存在于神经元的突触前末端。它们在帮助神经元之间传递信号方面发挥着至关重要的作用。位于它们表面上的最大蛋白是一种名为V-ATPase的花状分子。位于它旁边的是另一种叫做突触素(synaptophysin)的小蛋白。论文第一作者、Kudryashev实验室的Uljana Kravčenko说,科学家们认为这两种蛋白相互作用,但是在此之前没有人能够直接对它们进行成像。她解释说,“这项研究是首批直接可视化显示这两种蛋白在SV膜上定位的研究之一。”
这些作者还对神经元内部分组装的网格蛋白笼(clathrin cage)和空的网格蛋白笼的位置进行了成像,其中网格蛋白笼在细胞循环利用SV方面起着关键作用。Kravčenko说,这些网格蛋白笼比以前发现的更靠近细胞膜,这可能是SV循环利用的一种节能机制的标志,“但我们需要额外的实验来证明这一点”。
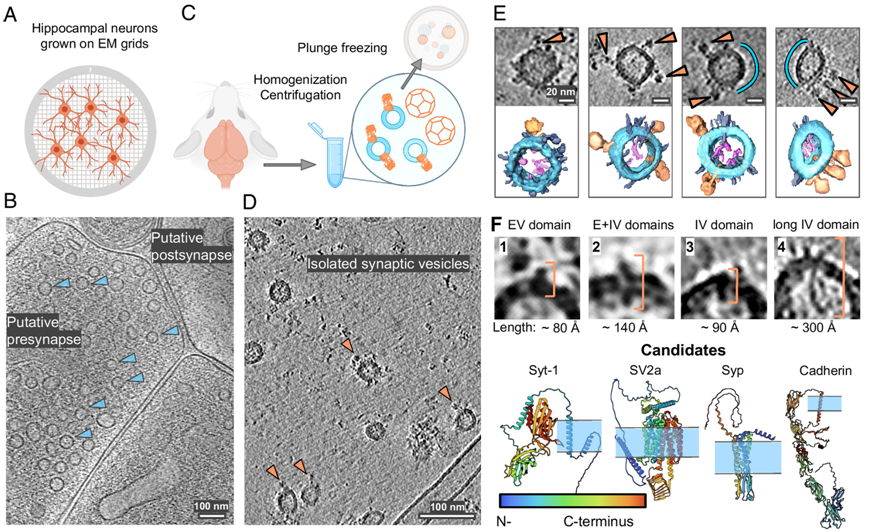
对单个SV及其表面蛋白进行可视化观察
她补充道,文献中很少有空的网格蛋白笼的图像。“我们首次发现空的网格蛋白笼更靠近细胞膜。这一观察提示着神经元中发现的空的网格蛋白笼所起的功能作用。”
低温电子断层扫描
低温电子断层扫描是一种成像技术,它以多个倾斜角度拍摄低温冷冻样本的二维图像,以重建生物样本的三维体积。它最常用于研究大分子、细胞器或细胞在空间上的组织方式,以亚纳米分辨率提供结构和背景见解。
与质谱或低温电镜等其他分析蛋白结构的方法不同,低温电子断层扫描使得科学家们能够在蛋白的天然环境中观察它们。其他需要更多步骤来处理样本的技术往往会丢失重要的结构信息。
Kravčenko说,“我们的方法将SV保持在天然状态,使我们能够对其表面上的各种蛋白进行成像。”低温电子断层扫描使得这些作者能够显示蛋白的空间组装,并揭示了V-ATPase和突触素之间的持续关联,这表明这种相互作用具有重要作用。
对神经学研究的影响
V-ATPase和突触素之间的相互作用为一些神经系统疾病的分子机制提供了见解。Kravčenko说,具体来说,这些疾病在SV循环利用和神经传递方面存在功能障碍。“如今我们知道这两种蛋白相互作用,这些信息可用于诊断,或开发针对与神经发育异常相关的疾病的治疗方法。”(生物谷 Bioon.com)
参考资料:
Uljana Kravčenko et al. Molecular architecture of synaptic vesicles. PNAS, 2024, doi:10.1073/pnas.2407375121.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


