JNI&GLIA|揭示α-syn致病蛋白与帕金森病两个重要特性间新关联
来源:焕一生物 2022-03-23 15:19
帕金森病(PD)是一种神经退行性疾病。近些年随着相关研究的推进,PD与免疫系统之间的关系变得更加清晰:比如免疫系统的持续激活会导致神经炎症,进而引起PD发病,并且多个PD相关的风险基因也被证实具有免疫调控作用。
2022年2月,焕一生物战略合作副总裁Dr. Robin Chan与浙江大学医学院及附属第一医院章京教授课题组、北京大学基础医学院病理学系杨迎教授课题组联合连续发表了2篇论文。Dr. Chan 在脂质代谢和神经疾病领域有十余年建树,专注于神经退行性疾病研究、病理学和细胞生物学等领域,曾任哥伦比亚大学脂质组学核心实验室创始主任,于国际顶尖期刊(Nature、Nat Neurosci.等)上发表论文逾 38 篇。
以上2篇合著论文荣登神经免疫学领域国际知名专业期刊 Journal of Neuroinflammation(影响因子:8.32)和神经胶质领域国际知名专业期刊 GLIA (影响因子:7.45)。章京教授和杨迎教授为2篇文章的共同通讯作者,其他共同作者包括来自浙江大学、北京大学、首都医科大学的多位学者。


帕金森病(PD)是一种神经退行性疾病。近些年随着相关研究的推进,PD与免疫系统之间的关系变得更加清晰:比如免疫系统的持续激活会导致神经炎症,进而引起PD发病,并且多个PD相关的风险基因也被证实具有免疫调控作用。这些发现在不同程度推动了帕金森病的免疫治疗研究进程。在此基础上,系统性地理解人体免疫调控网络,有助于深化科学家们对PD等神经类疾病发病机制的底层理解,也将有望为治疗帕金森病提供重要的新型潜在靶点,加速疾病的早筛和诊疗进程。
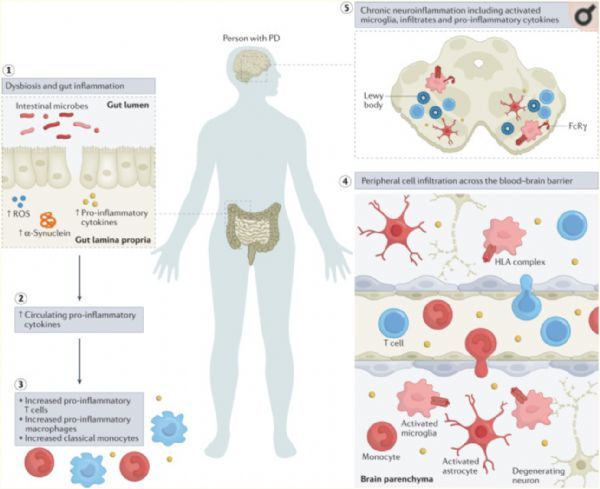
帕金森病的炎症临床表现(来源:Nat Rev Immunol2022年3月研究,Tansey et al.)
上述两项研究中,刊于JNI的“α-Synuclein-containing erythrocytic extracellular vesicles: essential contributors to hyperactivation of monocytes in Parkinson's disease”聚焦帕金森病(PD)发病机制的一个重要特性——外周单核细胞水平较高,明确了含α-突触核蛋白(α-syn)的红细胞胞外囊泡(RBC-EVs)对PD患者单核细胞过度激活过程的核心作用。刊于GLIA的“Astrocytic VEGFA: An essential mediator in blood-brain-barrier disruption in Parkinson's disease”重点关注α-syn与PD中血脑屏障 (BBB) 损害的关系,明确了寡聚α-syn在星形胶质细胞衍生的VEGFA介导的PD相关BBB破坏过程中起着关键作用。这两项研究对进一步探索PD发病机制均具有重要的参考价值。由于不同神经退行性疾病间存在相似的致病机制,如蛋白质异常聚集、内溶酶体失调、和免疫反应异常,上述研究也将拓展其他神经类疾病领域的研发和转化应用。
1. J Neuroinflammation, Liu et al
研究背景:免疫系统功能障碍,包括较高水平的外周单核细胞和炎症细胞因子,是帕金森病 (PD) 发病机制的一个重要特征,尽管该过程的机制仍有待研究。众所周知,参与 PD 的关键蛋白 α-突触核蛋白 (α-syn), 是中枢神经系统中小胶质细胞的强效激活因素。此外也有报道称 α-syn 存在于外周系统,尤其在红细胞(RBC)中是浓度极高的。考虑到红细胞直接暴露于循环单核细胞,本研究调查了含有α-syn的RBC是否参与PD患者的单核细胞过度激活。
研究成果:在这项研究中,我们检验了含有α-syn的RBC外泌体(RBC-EV)可以诱导PD患者单核细胞炎症增敏的假设。关键数据显示,与对照组相比,PD患者组和A53T小鼠组在基线时的炎性细胞因子mRNA表达和细胞因子分泌量均表现出更高水平, LPS刺激后炎性细胞因子的产生量显著提高。更重要的是,来自 PD患者和A53T小鼠的RBC-EV 在体外可诱导THP-1细胞和单核细胞过度激活, 但健康对照组和SNCA-KO小鼠的RBC-EV没有类似的作用。我们进一步证明,RBC-EV中含有的寡聚a-syn是这一机制的关键分子贡献者。此外,受体介导的内吞作用抑制剂或LRRK2激酶活性抑制剂可阻止含有寡聚体α-syn的RBC-EV诱导的单核细胞过度激活。
研究结论:本研究结果表明,含有病理性寡聚体 α-syn 的 RBC-EV 会导致循环单核细胞过度活化,这一过程需要受体介导的内吞作用和 LRRK2 激活。本研究数据为散发性 PD 中的免疫失调提供了新的视角,并强调了外周单核细胞中的 LRRK2 抑制是改善 PD 发病机制的潜在治疗靶点。
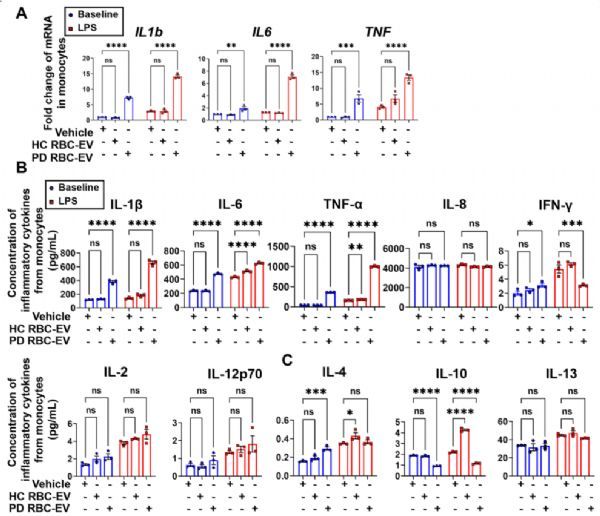
PD患者中RBC-EVs诱导的单核细胞的炎症敏感性
(A) 使用qPCR定量分析IL1b、IL6和TNF mRNA水平 使用MSD定量分析(B) 促炎细胞因子和(C)抗炎细胞因子
2. GLIA, Lan et al
研究背景:血脑屏障 (BBB) 的完整性对于大脑的正常功能、突触重塑和血管生成至关重要。BBB的破坏导致运输功能受损,通透性增加,并暴露于神经毒性分子,因此是中枢神经系统炎症的主要原因。BBB 破坏是帕金森病 (PD) 患者的常见病理学表现,且已假设对 PD 进展起促成作用。然而,PD 中 BBB 破坏的分子机制需要进一步研究。
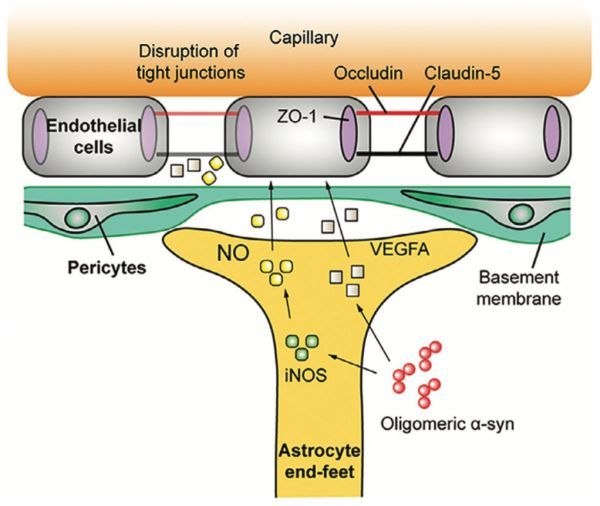
星形胶质细胞寡聚a-Syn激活引起血脑屏障(BBB)功能障碍机制的说明
(来源:GLIA 期刊文章简介)
研究成果:在本项研究中,我们假设α-突触核蛋白(α-syn)激活的星形胶质细胞可以减弱PD患者的BBB功能,并采用 A53T PD小鼠和 3 细胞型体外BBB模型研究了这种致病现象发生的分子机制。首先,PD小鼠研究表明,紧密连接相关蛋白的表达降低,血管通透性增加,且大脑中活化星形胶质细胞的寡聚 α-syn 水平出现积累。体外BBB模型研究表明,寡聚 α-Syn(而非单体或纤维α-Syn)暴露可对BBB完整性造成显著损害。 该过程涉及星形胶质细胞的寡聚α-syn激活,并由血管内皮生长因子A(VEGFA)和一氧化氮(NO)的表达和释放介导。在PD小鼠星形胶质细胞和PD患者的大脑中也观察到VEGFA和NO水平升高。在体外 BBB 模型中阻断 VEGFA和NO信号通路有效地保护血脑屏障免受寡聚 α-syn 的有害影响。最后,在 PD 小鼠模型中同样证实与 VEGFA 信号通路抑制相关的 BBB 完整性保护作用。
研究结论:本研究结论显示,暴露于寡聚α-syn导致星形胶质细胞显著激活,从而增加VEGFA和NO的产生和释放,导致BBB完整性的损害。这些结果表明,VEGFA和NO是BBB完整性保护的潜在有吸引力的治疗靶点。

PD小鼠大脑中紧密连接相关蛋白的表达显著降低,表明BBB功能障碍
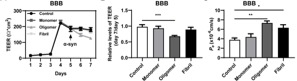
寡聚α-Syn(而非单体或纤维α-Syn)暴露可对体外BBB模型完整性造成显著损害,表现为跨内皮电阻(TEER)降低和跨内皮渗透性(Pe)增加
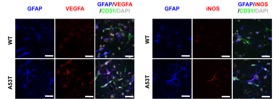
PD小鼠激活的星形胶质细胞中VEGFA和NOS(NO合酶)水平升高
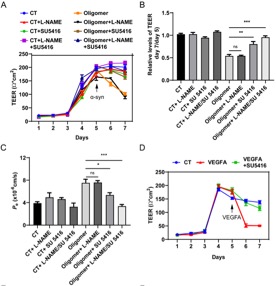
使用化学抑制剂SU5416或L-NAME阻断VEGFA和NO信号通路,体外BBB模型的完整性受到保护,免受(A-C)低聚物α-syn或(D)VEGFA的有害影响,如跨内皮电阻(TEER)和跨内皮渗透性(Pe)的挽救所示。SU5416=VEGFA抑制剂,L-NAME=NOS抑制剂。
原文链接:
1. Liu et al - https://pubmed.ncbi.nlm.nih.gov/35193594/
2. Lan et al - https://pubmed.ncbi.nlm.nih.gov/34713920/
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


