《自然》子刊:突破性进展!复旦团队首次将星形胶质细胞重编程成脊髓类器官,并修复脊髓损伤
来源:奇点糕 2022-12-26 10:53
邵志成团队开发了可将人星形胶质细胞转化为神经类器官的方法,证明了移植后的脊髓类器官可拥有脊髓细胞特性,并能够与宿主神经元相整合,有助于脊髓损伤的恢复。
让脊髓损伤的瘫痪患者重新站起来,一直是医学界最想要解决的难题之一。目前,解决这一问题较为成熟的方法是移植各种具有神经修复功能的细胞到脊髓损伤处,如少突胶质细胞前体细胞[1]、神经干细胞[2]和人多能干细胞(hPSC)[3]等。
虽然这些方法对于改善脊髓损伤小鼠的运动功能具有一定的效果,但是或多或少都存在一定缺陷,如原始细胞获取困难、需要进行移植手术以及移植后的排斥反应等[4]。近年来,科学家提出了一种新治疗策略来解决以上的问题,那就是直接在体内重编程神经胶质细胞,使其成为具有治疗脊髓损伤的能力[5]。
已有研究表明,通过基因编辑联合小分子化合物,人类和小鼠的星形胶质细胞可以在体外、体内有效地转化为不同种类、不同功能的神经元,但这些神经元无法增殖并形成类似神经系统结构的神经类器官,因而治疗潜力有限[6, 7]。
近日,来自复旦大学的邵志成团队在《自然·生物医学工程》杂志发表重磅研究成果,他们开发了将星形胶质细胞诱导成为神经类器官的方法(称为Op53-CSBRY),即在人星形胶质细胞中过表达OCT4(O)、抑制p53,以及添加小分子化合物CHIR99021(C)、SB431542(SB)、RepSox(R)和Y27632(Y)[8]。
更为重要的是,通过Op53-CSBRY方法生成的类器官,在添加bFGF、SAG和BMP激活脊髓发育相关信号通路后,可形成具有脊髓背侧和腹侧神经元功能的脊髓类器官。在将脊髓类器官移植给脊髓损伤的小鼠后,类器官可存活并分化为脊髓神经元,并与宿主神经元形成突触,改善小鼠的运动功能。
该研究使得人星形胶质细胞在体内直接重编程为神经类器官,以修复神经系统损伤的设想往前迈出了一大步。

论文首页截图
为了使神经胶质细胞形成神经类器官,研究人员首先在人星形胶质细胞中过表达OCT4(维持细胞多潜能性,为诱导产生多能干细胞的必要因子[9])的同时敲低p53(可促进细胞增殖[10])[以下称为Op53],但他们发现仅有少数星形胶质细胞可以重编程为MAP2+(神经元标志物)细胞。
为了提高星形胶质细胞转化效率,研究人员通过对15种参与神经分化或体细胞重编程的小分子化合物进行筛选后,发现当用CHIR99021、SB431542、RepSox和Y27632处理Op53星形胶质细胞时,其重编程为MAP2+神经元的效率显著增加(>8%),而同时添加这4种化合物(CSBRY)可进一步提高转化效率。
这表明人星形胶质细胞可以在体外通过Op53-CSBRY方法重编程为神经元。
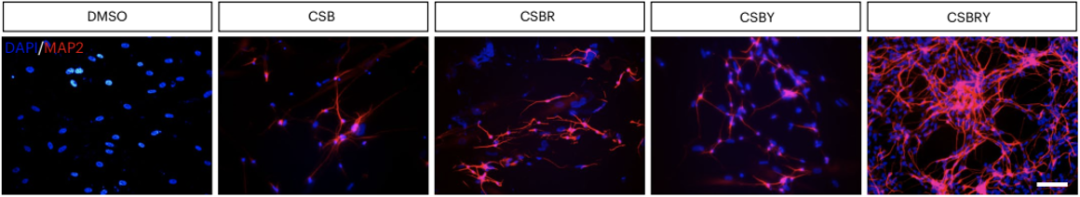
CSBRY可提高Op53细胞转化为神经元效率
但能转化为神经元还不够,还得能形成具有神经结构或功能的神经类器官,这样才有可能用来治疗脊髓损伤。
因此,研究团队对经Op53-CSBRY处理的人星形胶质细胞进行观察,发现在悬浮培养条件下的第14天,细胞形成了许多球形结构。进一步将细胞接种到基质胶后,球状结构可进一步生长,在培养到第15周时直径可达到4-5毫米。
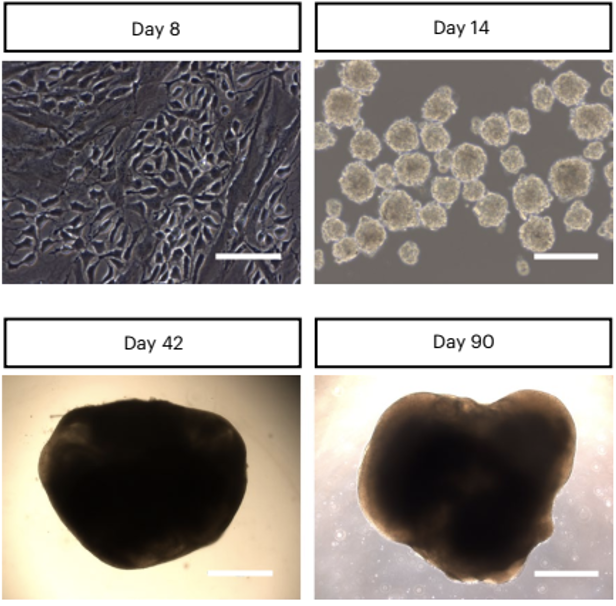
经Op53-CSBRY处理的人星形胶质细胞可生长为球形结构
同时,经过一系列的染色,研究人员发现培养出的球形结构具备脑类器官结构,如深部脑皮层标志物CTIP2+和TBR1+的细胞分布在PAX6+细胞构成的脑室带样结构的外侧,而表层神经元标志物SATB2+和BRN2+的细胞位于中间层,并与Reelin+细胞分离,这类似于大脑皮层的I层边缘区。
这些发现表明,Op53-CSBRY可诱导人星形胶质细胞转化为脑类器官。
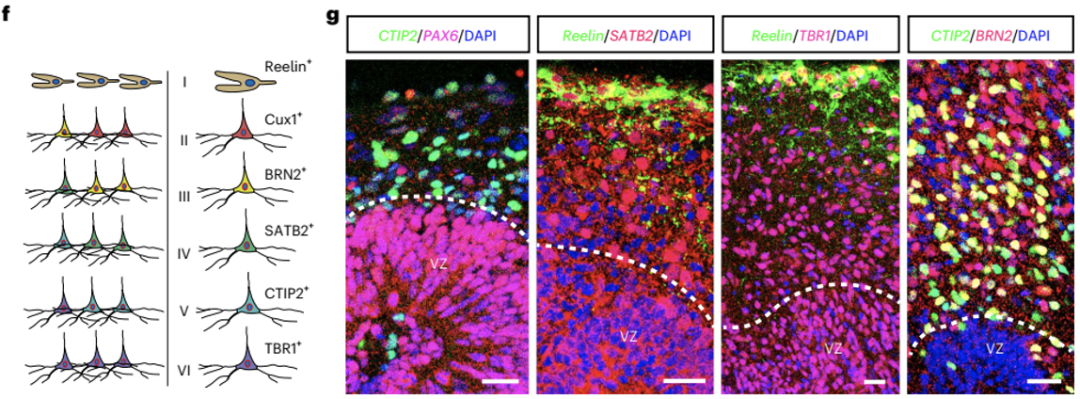
Op53-CSBRY可诱导人星形胶质细胞转化为脑类器官
先前有研究表明,FGF、SHH和BMP4相关通路对于脊髓组织的发育具有调控作用[11]。研究人员猜想,既然Op53-CSBRY可诱导人星形胶质细胞转化为脑类器官,那么再调控这些通路能否使其转化为脊髓类器官呢?
为了搞清楚这个问题,研究人员在Op53-CSBRY诱导的星形胶质细胞中添加了bFGF、SAG(SHH通路激动剂)和BMP4,并发现长成的类器官果然显示出了类似脊髓的结构。脊髓腹侧祖细胞标志物Nkx6.1、Olig2以及脊髓背侧祖细胞标志物Olig3在形成的类器官中高度表达。同时,Nkx6.1+细胞形成脑室带样结构,背侧Olig3+细胞与腹侧Nkx6.1+细胞明显分离,且Olig2+腹侧运动神经前体细胞与Nkx6.1+细胞共定位。
更为重要的是,研究人员还观察到生成的类器官中有不同亚型的脊髓神经元,如ChAT+或HB9+脊髓特异性运动神经元、GAD67+抑制性中间神经元和VGLUT1+兴奋性神经元。
这些结果表明,该方法可诱导星形胶质细胞形成脊髓类器官(hADSC类器官)。
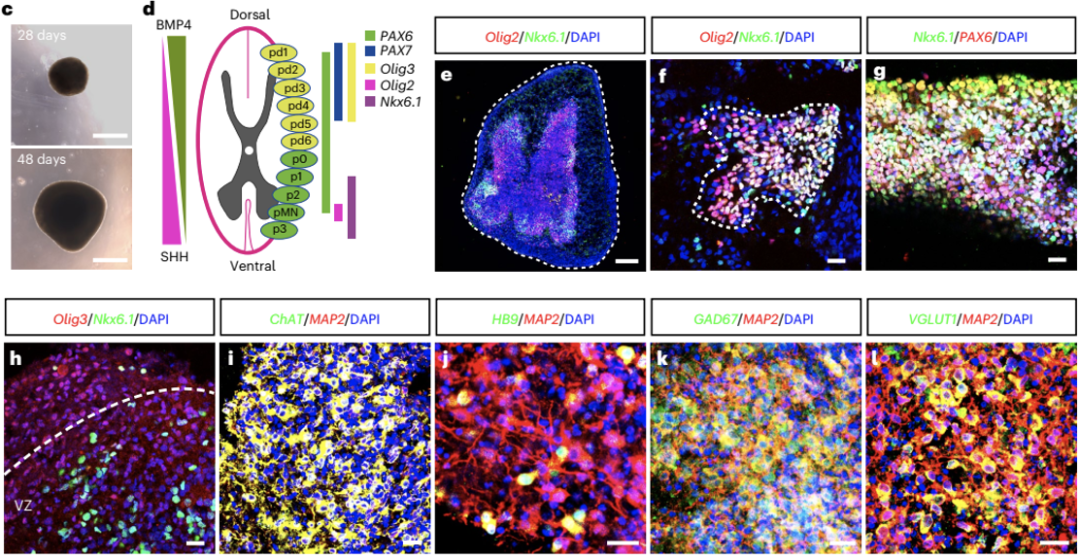
在Op53-CSBRY诱导的星形胶质细胞中添加了bFGF、SAG和BMP4可诱导星形胶质细胞形成脊髓类器官
为了进一步研究hADSC类器官的特征,研究人员对其进行了单细胞RNA测序和电生理分析,结果均再次表明hADSC类器官包括了脊髓中的主要神经元亚型,并具有完整的神经元功能。
接下来便是测试研究所得到的hADSC类器官是否能够对脊髓损伤起到治疗效果。
研究人员将GFP标记的hADSC类器官移植到了7周龄免疫缺陷小鼠的脊髓中,这些小鼠在T10(第10胸髓)处被完全切除。
实验结果显示,hADSC类器官可在小鼠体内正常生长,形成脊髓腹侧和背侧祖细胞以及脊髓的主要神经元亚型,并在移植6周后与宿主小鼠的脊髓相融合,即hADSC类器官中的神经元与小鼠脊髓中的神经元形成突触结构。
这些结果表明移植的hADSC类器官可存活并分化成脊髓神经元,建立与宿主神经元的突触连接,从而重新连接完全受损的脊髓组织。
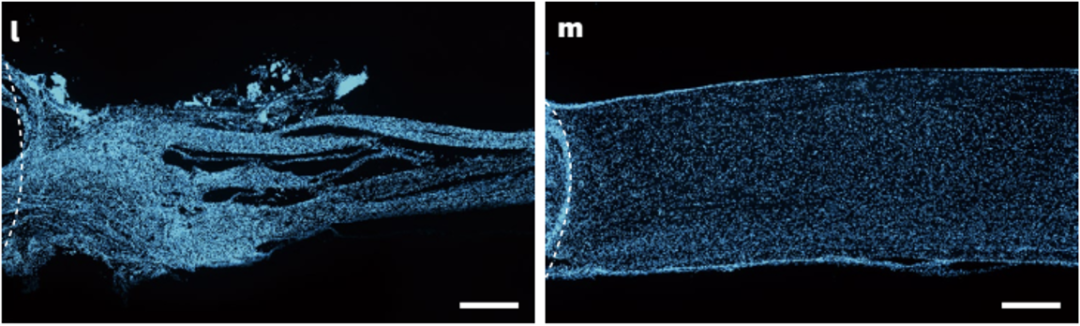
移植的hADSC类器官可重新连接完全受损的脊髓组织
最后,小鼠的运动功能测试表明,在hADSC类器官移植6周后,虽然小鼠自发运动功能没有明显改善,但在强烈刺激后小鼠可表现出后肢运动反应,表明类器官移植有可能增强脊髓损伤后的运动功能。
总的来说,邵志成团队开发了可将人星形胶质细胞转化为神经类器官的方法,证明了移植后的脊髓类器官可拥有脊髓细胞特性,并能够与宿主神经元相整合,有助于脊髓损伤的恢复。
这一研究成果为今后直接在体内重编程内源性胶质细胞修复神经损伤,打下了坚实的基础。
参考文献
1.Andersen J, Revah O, Miura Y, Thom N, Amin ND, Kelley KW, Singh M, Chen X, Thete MV, Walczak EM et al: Generation of Functional Human 3D Cortico-Motor Assembloids. Cell 2020, 183(7):1913-1929 e1926.
2.Lu P, Ceto S, Wang Y, Graham L, Wu D, Kumamaru H, Staufenberg E, Tuszynski MH: Prolonged human neural stem cell maturation supports recovery in injured rodent CNS. J Clin Invest 2017, 127(9):3287-3299.
3.Nori S, Okada Y, Yasuda A, Tsuji O, Takahashi Y, Kobayashi Y, Fujiyoshi K, Koike M, Uchiyama Y, Ikeda E et al: Grafted human-induced pluripotent stem-cell-derived neurospheres promote motor functional recovery after spinal cord injury in mice. Proc Natl Acad Sci U S A 2011, 108(40):16825-16830.
4.Di Lullo E, Kriegstein AR: The use of brain organoids to investigate neural development and disease. Nat Rev Neurosci 2017, 18(10):573-584.
5.Li H, Chen G: In Vivo Reprogramming for CNS Repair: Regenerating Neurons from Endogenous Glial Cells. Neuron 2016, 91(4):728-738.
6.Niu W, Zang T, Zou Y, Fang S, Smith DK, Bachoo R, Zhang CL: In vivo reprogramming of astrocytes to neuroblasts in the adult brain. Nat Cell Biol 2013, 15(10):1164-1175.
7.Rivetti di Val Cervo P, Romanov RA, Spigolon G, Masini D, Martin-Montanez E, Toledo EM, La Manno G, Feyder M, Pifl C, Ng YH et al: Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson's disease model. Nat Biotechnol 2017, 35(5):444-452.
8.Xu J, Fang S, Deng S, Li H, Lin X, Huang Y, Chung S, Shu Y, Shao Z: Generation of neural organoids for spinal-cord regeneration via the direct reprogramming of human astrocytes. Nat Biomed Eng 2022.
9.Huangfu D, Osafune K, Maehr R, Guo W, Eijkelenboom A, Chen S, Muhlestein W, Melton DA: Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2. Nat Biotechnol 2008, 26(11):1269-1275.
10.Hafner A, Bulyk ML, Jambhekar A, Lahav G: The multiple mechanisms that regulate p53 activity and cell fate. Nat Rev Mol Cell Biol 2019, 20(4):199-210.
11.Kumamaru H, Kadoya K, Adler AF, Takashima Y, Graham L, Coppola G, Tuszynski MH: Generation and post-injury integration of human spinal cord neural stem cells. Nat Methods 2018, 15(9):723-731.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


