Circulation | 北京大学李子健等团队合作发现预防心力衰竭的潜在新策略
来源:生物探索 2024-02-13 11:42
该研究证明了磷酸化调控的HIP-55动态相分离可以保护β-AR介导的HF。此外,研究发现HIP-55具有很强的相分离能力,受AKT介导的S269和T291磷酸化的调节。
北京大学李子健及中国科学院上海有机化学研究所刘聪共同通讯在Circulation(IF 38)在线发表题为“Phosphorylation-Regulated Dynamic Phase Separation of HIP-55 Protects Against Heart Failure”的研究论文,该研究表明磷酸化调控的动态液-液相分离HIP-55 (55 kDa造血祖激酶1相互作用蛋白)对HF有保护作用。遗传缺失的HIP-55加重了HF,而心脏特异性过表达的HIP-55在体内可显著减轻HF。HIP-55具有很强的相分离能力。HIP-55的相分离受AKT介导的S269和T291位点磷酸化的动态调控,磷酸化失败会导致HIP-55的动态相分离受损,形成异常聚集。
长时间的交感神经过度激活应激导致HIP-55 S269和T291磷酸化降低,相分离失调,HIP55随后聚集形成。此外,还证明了HIP-55的动态相分离在抑制β-肾上腺素能受体介导的P38/MAPK(丝裂原活化蛋白激酶)信号通路的过度激活方面的重要作用。磷酸化缺陷的HIP-55突变,经历大量相分离并形成不溶性聚集体,失去对HF的保护活性。该研究表明,磷酸化调控的HIP-55动态相分离可防止交感/肾上腺素能系统介导的心力衰竭。

心衰(HF)是各种心血管疾病的终末阶段,与高发病率和死亡率相关。5年生存率约为45.5%,低于大多数恶性肿瘤。慢性心衰通常以复发和再入院的高风险为特征,这大大增加了经济负担。因此,了解心衰预后恶化的病理机制具有重要意义。交感神经活动对于维持正常的心脏生理功能和反应是必不可少的正常生理和心衰。因此,有必要揭示生理与病理之间的动态开关机制,并确定其促成HF的关键分子开关。
近年来的研究强调了蛋白液-液相分离(LLPS)在正常生理和病理条件下的双重作用。LLPS是一种蛋白质从分散状态转变为聚集状态的过程,有助于各种基本的生物行为,如信号转导、酶促反应和基因转录等。LLPS过程受翻译后修饰、蛋白-蛋白相互作用和其他因素的复杂调控。这个系统的紊乱会导致严重的疾病,包括神经系统紊乱和癌症,然而,LLPS在心血管疾病中的作用尚不清楚。
利用蛋白质组学方法揭示了一种新的β-AR调节蛋白HIP-55 (55 kDa造血祖激酶1相互作用蛋白)在心脏重塑中的作用。HIP-55可负向调节受体下游信号作为一个多结构域的接头蛋白,HIP-55在其N端具有一个肌动蛋白结合结构域,在其C端具有一个SH3 (Src同源3)结构域通过这些结构域,HIP-55能够与几个关键的信号分子相互作用,包括F-肌动蛋白、MAP4K1激酶和Src激酶,从而触发细胞反应,如内吞作用、增殖和细胞存活。此外,通过结构分析,发现了位于HIP55中间区域的低复杂性域(LCD)。LCD已被证明是LLPS的结构基础。因此,HIP-55可能通过LLPS发挥作用。
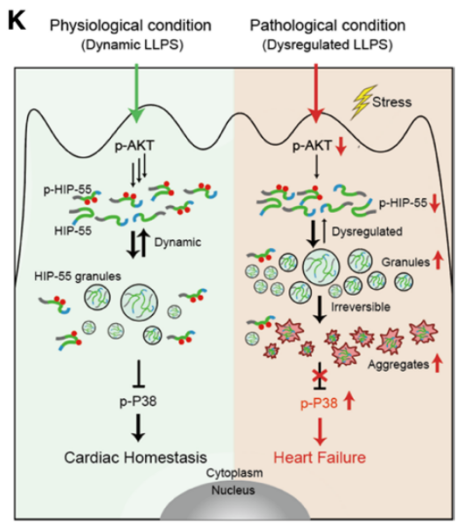
磷酸化调控的动态相分离HIP-55对防止心力衰竭是必要的(Credit: Circulation)
该研究证明了磷酸化调控的HIP-55动态相分离可以保护β-AR介导的HF。此外,研究发现HIP-55具有很强的相分离能力,受AKT介导的S269和T291磷酸化的调节。长时间交感应激导致HIP-55 S269/T291磷酸化降低,相分离失调,导致后续HIP-55聚集形成。根据这一机制,磷酸化缺陷的S269A/ T291A突变的HIP55在心脏特异性过表达,倾向于形成大量失调的颗粒和不溶性聚集体,不能抑制HF的进展。该研究不仅将延长的交感神经过度激活和失调的相分离与HF联系起来,而且暗示了HIP-55调节相分离的治疗靶向潜力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


