新洞察!基因工程多功能外泌体诱导抗癌免疫
来源:生物谷原创 2022-07-07 10:21
外泌体是自然产生的膜性小泡,来源于各种类型的细胞。外泌体的直径在30到150纳米之间,携带着来自亲本细胞的大量物质。
外泌体是自然产生的膜性小泡,来源于各种类型的细胞。外泌体的直径在30到150纳米之间,携带着来自亲本细胞的大量物质。外泌体通过与细胞表面受体和配体的直接相互作用和/或通过不同的方式进行物质转移,能够调节受体细胞的生理和病理生理。这些纳米尺度的囊泡被认为是细胞间短距离和长距离通讯的关键媒介。
与传统的纳米药物不同,外泌体在治疗开发方面具有独特的优势。尽管Exosome在药物输送方面取得了重大成功,但Exosome用于免疫治疗的全部潜力仍未被开发。

图片来源: https://doi.org/10.1016/j.ymthe.2022.06.013.
近日,来自南加州大学的研究者们在Molecular Therapy杂志上发表了题为“Eliciting anti-cancer immunity by genetically engineered multifunctional exosomes”的文章,该研究揭示了基因工程多功能外泌体诱导抗癌免疫的研究。
在这里,研究者设计了以表面展示的抗体靶向基团和免疫调节蛋白为特征的基因工程外泌体。通过与胞外膜蛋白的遗传融合,Expi293F细胞来源的外泌体配备了针对人T细胞CD3和表皮生长因子受体(EGFR)的单抗以及免疫检查点调节剂、程序性死亡1(PD-1)和OX40配体(OX40L)。
由此产生的基因工程多功能免疫调节外泌体(Gemini-Exos)不仅可以重定向并激活T细胞杀伤EGFR阳性的三重阴性乳腺癌(TNBC)细胞,而且还可以诱导强大的抗癌免疫,对小鼠已建立的TNBC肿瘤产生高度有效的抑制作用。
Gemini-Exos代表了免疫治疗的候选药物,并可能为产生具有所需功能和特性的基于外泌体的免疫治疗药物提供一种通用策略。
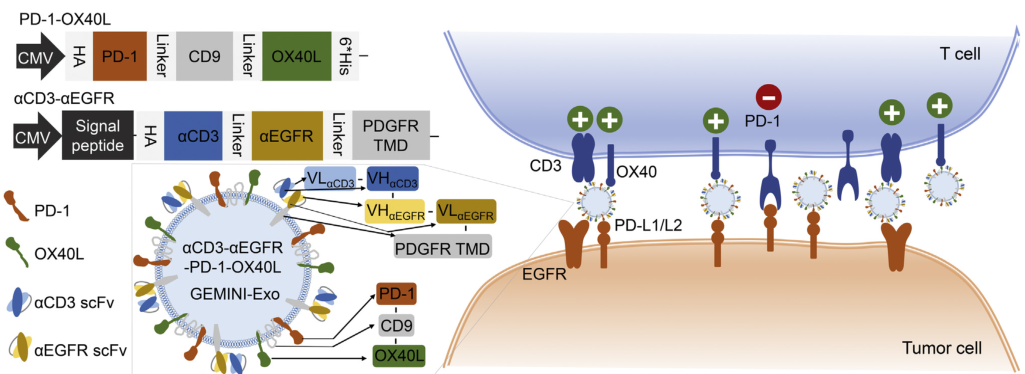
靶向肿瘤免疫治疗的aCD3-aEGFR-PD-1-OX40L Gemini-Exos示意图
图片来源: https://doi.org/10.1016/j.ymthe.2022.06.013.
综上所述,研究者设计并产生了CD3-aEGFR-PD-1OX40L Gemini-Exos,通过在外泌体表面同时展示单抗和免疫调节蛋白来实现。产生的Gemini-Exos不仅可以招募和激活人T细胞对抗EGFR阳性的肿瘤,而且可以诱导强大的肿瘤特异性免疫反应,导致显著的体内抗肿瘤效果。这项工作展示了Gemini-Exos在癌症免疫治疗中的潜力,并可能为开发具有所需药理活性的免疫治疗外泌体提供一般方法。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


