Nature:我国科学家揭示钙调蛋白调节RyR2受体机制,为治疗心脏病奠定基础
来源:本站原创 2019-07-23 21:21
2019年7月23日讯/生物谷BIOON/---心肌收缩是由钙离子流入细胞质触发的,最初是由Cav1.2介导的细胞外环境中的钙离子流入触发的,随后是由兰尼碱受体2(ryanodine receptor 2, RyR2)介导的肌浆网钙库中的钙离子流入触发的。兰尼碱受体是已知最大的离子通道,由分子量大于2兆道尔顿(MDa)的同源四聚体组成。80%以上的兰尼碱受体折叠成一种多结构域的细胞质组装体,可感知
2019年7月23日讯/生物谷BIOON/---心肌收缩是由钙离子流入细胞质触发的,最初是由Cav1.2介导的细胞外环境中的钙离子流入触发的,随后是由兰尼碱受体2(ryanodine receptor 2, RyR2)介导的肌浆网钙库中的钙离子流入触发的。兰尼碱受体是已知最大的离子通道,由分子量大于2兆道尔顿(MDa)的同源四聚体组成。80%以上的兰尼碱受体折叠成一种多结构域的细胞质组装体,可感知与各种调节物(从离子到蛋白)之间的相互作用。对RyR2活性的精确调控对于每次心跳都是至关重要的。异常的RyR2活性与危及生命的心律失常相关。
分子量为17kDa的钙调蛋白(CaM)是一种重要的钙传感器,在大多数钙信号转导事件中起着重要作用。CaM由大致对称的N-末端叶和C-末端叶(下文中的N-叶和C-叶)组成,并且C-叶和N-叶由柔性铰链连接在一起。每个末端叶能够通过两个EF-手(螺旋E-手和螺旋F-手)基序协同性地结合两个钙离子,结合亲和力在微摩尔范围内。在钙离子结合后,两个末端叶中的几个疏水性氨基酸残基的暴露促进CaM与靶序列的结合。CaM与兰尼碱受体直接相互作用,CaM-RyR原聚体的化学计量比为1:1,结合亲和力在纳摩尔范围内。
然而,CaM对兰尼碱受体的调节是异构型特异性的。CaM显示出对RyR1的双相调节,在纳摩尔水平的钙离子下作为一种较弱的激活剂(apo-CaM),在纳摩尔水平的钙离子下作为一种抑制剂(Ca2+-CaM)发挥作用。相反,apo-CaM对RyR2没有影响或抑制作用,而Ca2+-CaM抑制RyR2。
CaM还经证实有助于终止钙库过载诱导的钙离子释放。CaM和RyR2之间的异常相互作用与心力衰竭相关,并且对受损的CaM-RyR2相互作用进行校正可能作为一种治疗压力负荷性心力衰竭(pressure-overload-induced heart failure)中致死性心律失常的方法。
对RyR-CaM复合物的结构表征受限于低分辨率的电子显微镜图,现有的电子显微镜图表明apo-CaM和Ca2+-CaM在RyR1中存在两个重叠但不同的结合位点。一种对应于RyR1的氨基酸残基3614-3643(RyR2的中心结构域中的氨基酸残基3581-3612)的肽结合apo-CaM和Ca2+-CaM。与这种肽结合在一起时的Ca2+-CaM的晶体结构揭示出这种肽的N末端和C末端的疏水性锚点分别容纳Ca2+-CaM的C-叶和N-叶。
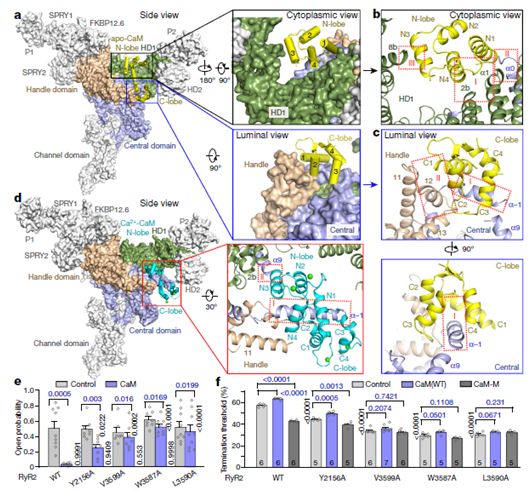
在一项新的研究中,来自为了阐明CaM对RyR2的调节,来自中国清华大学和加拿大卡尔加里大学的研究人员报道了RyR2的低温电镜(cryo-EM)结构,它们共同地揭示了不同形式的CaM对分子识别特征,并针对CaM对RyR2通道门控的调节提供了新的见解。相关研究结果近期发表在Nature期刊上,论文标题为“Modulation of cardiac ryanodine receptor 2 by calmodulin”。
这些研究人员通过解析出RyR2在8种条件下的结构,揭示出人CaM对猪RyR2的调控机制。apo-CaM和Ca2+-CaM结合在一个由手柄、螺旋和中心结构域形成的狭长裂缝中,但是它们的结合位点是不同的,但存在一定的重叠。RyR2上的CaM结合位点转移是由钙离子结合到CaM而不是RyR2上来控制的。Ca2+-CaM诱导单个中心结构域的旋转和结构域内转移,从而导致由PCB95和Ca2+激活的RyR2离子通道的孔隙关闭。相比之下,由ATP、咖啡因和钙离子激活的RyR2离子通道的孔隙在Ca2+-CaM存在下保持开放。这表明Ca2+-CaM是RyR2离子通道门控的多种竞争性调节物之一。(生物谷 Bioon.com)
参考资料:
Deshun Gong et al. Modulation of cardiac ryanodine receptor 2 by calmodulin. Nature, 2019, doi:10.1038/s41586-019-1377-y.
分子量为17kDa的钙调蛋白(CaM)是一种重要的钙传感器,在大多数钙信号转导事件中起着重要作用。CaM由大致对称的N-末端叶和C-末端叶(下文中的N-叶和C-叶)组成,并且C-叶和N-叶由柔性铰链连接在一起。每个末端叶能够通过两个EF-手(螺旋E-手和螺旋F-手)基序协同性地结合两个钙离子,结合亲和力在微摩尔范围内。在钙离子结合后,两个末端叶中的几个疏水性氨基酸残基的暴露促进CaM与靶序列的结合。CaM与兰尼碱受体直接相互作用,CaM-RyR原聚体的化学计量比为1:1,结合亲和力在纳摩尔范围内。
然而,CaM对兰尼碱受体的调节是异构型特异性的。CaM显示出对RyR1的双相调节,在纳摩尔水平的钙离子下作为一种较弱的激活剂(apo-CaM),在纳摩尔水平的钙离子下作为一种抑制剂(Ca2+-CaM)发挥作用。相反,apo-CaM对RyR2没有影响或抑制作用,而Ca2+-CaM抑制RyR2。
CaM还经证实有助于终止钙库过载诱导的钙离子释放。CaM和RyR2之间的异常相互作用与心力衰竭相关,并且对受损的CaM-RyR2相互作用进行校正可能作为一种治疗压力负荷性心力衰竭(pressure-overload-induced heart failure)中致死性心律失常的方法。
对RyR-CaM复合物的结构表征受限于低分辨率的电子显微镜图,现有的电子显微镜图表明apo-CaM和Ca2+-CaM在RyR1中存在两个重叠但不同的结合位点。一种对应于RyR1的氨基酸残基3614-3643(RyR2的中心结构域中的氨基酸残基3581-3612)的肽结合apo-CaM和Ca2+-CaM。与这种肽结合在一起时的Ca2+-CaM的晶体结构揭示出这种肽的N末端和C末端的疏水性锚点分别容纳Ca2+-CaM的C-叶和N-叶。

CaM和RyR2之间的界面,图片来自Nature, 2019, doi:10.1038/s41586-019-1377-y。
在一项新的研究中,来自为了阐明CaM对RyR2的调节,来自中国清华大学和加拿大卡尔加里大学的研究人员报道了RyR2的低温电镜(cryo-EM)结构,它们共同地揭示了不同形式的CaM对分子识别特征,并针对CaM对RyR2通道门控的调节提供了新的见解。相关研究结果近期发表在Nature期刊上,论文标题为“Modulation of cardiac ryanodine receptor 2 by calmodulin”。
这些研究人员通过解析出RyR2在8种条件下的结构,揭示出人CaM对猪RyR2的调控机制。apo-CaM和Ca2+-CaM结合在一个由手柄、螺旋和中心结构域形成的狭长裂缝中,但是它们的结合位点是不同的,但存在一定的重叠。RyR2上的CaM结合位点转移是由钙离子结合到CaM而不是RyR2上来控制的。Ca2+-CaM诱导单个中心结构域的旋转和结构域内转移,从而导致由PCB95和Ca2+激活的RyR2离子通道的孔隙关闭。相比之下,由ATP、咖啡因和钙离子激活的RyR2离子通道的孔隙在Ca2+-CaM存在下保持开放。这表明Ca2+-CaM是RyR2离子通道门控的多种竞争性调节物之一。(生物谷 Bioon.com)
参考资料:
Deshun Gong et al. Modulation of cardiac ryanodine receptor 2 by calmodulin. Nature, 2019, doi:10.1038/s41586-019-1377-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


