《分子精神病学》:换血能让AD小鼠大脑中Aβ少沉积80%!这会是个新希望吗?
来源: 奇点糕 2022-07-28 14:09
阿尔茨海默病(AD)是老年人口中导致痴呆的最常见原因,病理上以大脑中β淀粉样蛋白(Aβ)的错误折叠、寡聚化和沉积为主要特征[1]。
阿尔茨海默病(AD)是老年人口中导致痴呆的最常见原因,病理上以大脑中β淀粉样蛋白(Aβ)的错误折叠、寡聚化和沉积为主要特征[1]。
尽管几十年来科学家们锲而不舍地对AD的发病机制进行探索,但遗憾的是目前治疗AD的方法很有限,而预防和清除脑内沉积的Aβ聚集体被认为是治疗AD的最有前途的策略之一。
2014年,《自然·医学》杂志刊登了斯坦福大学医学院神经科学教授Tony Wyss-Coray团队的研究成果,他们发现,将年轻小鼠的血液注射到年老小鼠体内,可以改善年老小鼠的记忆力和学习能力[2],展现了换血治疗改善认知功能的潜力。
近日,来自德克萨斯大学休斯顿健康科学中心的Claudio Soto教授和Akihiko Urayama教授团队在转基因AD小鼠模型(Tg2576)中发现,通过将Tg2576小鼠的血液替换为具有相同遗传背景的野生型小鼠的血液,Tg2576小鼠大脑中淀粉样斑块的形成显著减少了40%-80%。
更重要的是,Tg2576小鼠空间记忆能力也得到了明显改善。这一发现将为AD的治疗开辟一种新的策略,相关成果发表于著名杂志《分子精神病学》上[3]。

大脑中Aβ水平受到严格的调控,而AD患者大脑中Aβ清除率较正常人下降25-30%,提示Aβ清除机制受损在AD的发生发展中可能起着至关重要的作用[4]。
有意思的是,单体和寡聚体Aβ均可双向跨越血脑屏障[5],外周循环中的Aβ和大脑中沉积的Aβ之间存在紧密的关系[6],并保持动态平衡,血浆中Aβ的减少会导致大脑中Aβ快速外流[7, 8]。
在以上研究的基础上,早在2017年,陆军军医大学的王延江教授团队就报道了将转基因AD小鼠(APPswe/PS1dE9双转基因模型,可表达突变的人类早老素1和淀粉样前体蛋白)与野生型小鼠异种共生,即通过手术将两只小鼠的循环系统进行连接、使血液可进行交换,野生型小鼠脑内出现明显的淀粉样蛋白沉积,首次揭示了血源性Aβ可以进入大脑,形成与Aβ相关的病理改变,并导致神经元功能障碍[9]。
紧接着,多个研究报道了将含有Aβ聚合体的脑匀浆[10]或已有明显Aβ沉积的老年动物的全血或血浆[11]直接从静脉注射到健康动物体内,可促进动物出现脑淀粉样血管病以及加速大脑淀粉样变性。这些研究表明了循环中的Aβ也可导致AD的发生发展。
根据以上研究结果,科学家们自然地想到,既然外周循环和大脑中的Aβ之间保持动态平衡,那么能否通过血液交换使血液循环中Aβ减少,从而使脑内Aβ进入循环,减少脑内Aβ沉积来治疗或改善AD呢?
带着以上问题,Claudio Soto教授和Akihiko Urayama教授团队对表达人突变淀粉样前体蛋白(APP)的转基因小鼠(Tg2576)进行在3月龄时开始血液置换,每次置换1.8–2.4 mL,约占到小鼠总体血液的40%到60%,置换的血液来自相同背景的野生型小鼠,每月1次,连续10个月,在第13个月对小鼠大脑进行检测。
结果发现,假手术组(抽自体血回输)和未治疗组Tg2576小鼠大脑皮层和海马区都观察到丰富的大脑淀粉样斑块,而在换血Tg2576小鼠中只观察到少量和小的斑块,大脑皮层和海马区斑块数量分别减少了50.0%和64.2%、斑块面积分别减少了75.6%和75.9%。
这些发现表明,血液置换有效地减少了Tg2576小鼠大脑淀粉样斑块的形成。
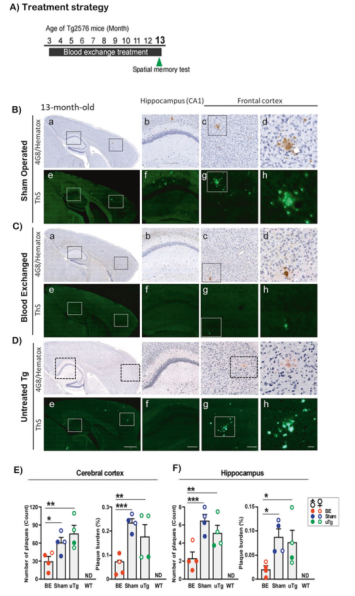
血液置换有效地减少了Tg2576小鼠大脑淀粉样斑块的形成
为了进一步研究血液置换是否可改善AD小鼠的空间记忆功能,研究人员对小鼠进行了巴恩斯迷宫实验,结果显示,无论是短期记忆还是长期记忆,与假手术组或未治疗组Tg2576小鼠相比,换血组小鼠均有显著更好的表现,达到了野生型小鼠的记忆水平,表明了血液置换可改善Tg2576小鼠的空间记忆能力,甚至可达到野生型小鼠的水平。
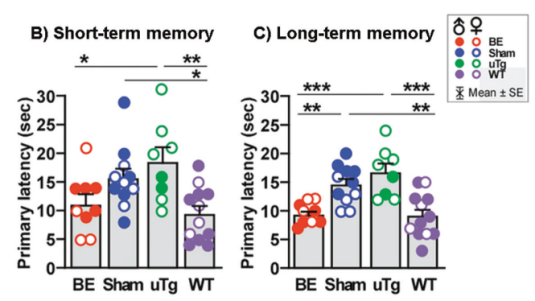
血液置换可改善Tg2576小鼠的空间记忆能力
为了研究血液置换治疗是否可持续减少大脑淀粉样蛋白的沉积,研究人员将血液置换治疗的时间延长了4个月。
结果不出所料,相比于假手术组和未治疗组Tg2576小鼠,连续接受14个月血液置换治疗的Tg2576大脑淀粉样斑块负担显著更少,表明了血液置换治疗可持续减少Tg2576小鼠的脑内淀粉样斑块形成。
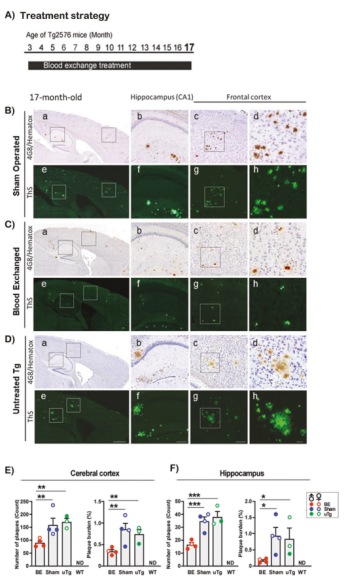
血液置换治疗可持续减少Tg2576小鼠的脑内淀粉样斑块形成
研究人员还通过比较不同组小鼠在13和17月龄时观察到的淀粉样蛋白负荷,进而估算出斑块的生长速度。
在整个研究期间,血液置换治疗对降低大脑皮层和海马区的斑块负担有显著效果,换血组Tg2576小鼠大脑皮层(0.075%/月)和海马区(0.037%/月)斑块生长速度明显低于假手术组(皮层和海马区分别为0.158%/月和0.214%/月),表明血液置换不仅可减少Aβ聚集体的沉积,而且还降低了斑块的生长速度。
对于血液置换可导致大脑淀粉样斑块显著减少,一种可能的解释是,这一过程改变了大脑和血液中Aβ池之间的动态平衡,而13月龄时换血组Tg2576小鼠大脑中的可溶性Aβ减少这一结果也支持这一假设。
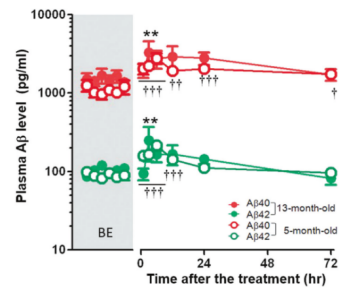
为了进一步研究这一问题,研究人员对5月龄(脑淀粉样变性发病前)和13月龄(脑淀粉样变性发病后)Tg2576小鼠在血液置换治疗后不同时间点的血浆Aβ水平进行了检测。
研究结果显示,无论是5月龄的小鼠还是13月龄的小鼠,血浆Aβ浓度在治疗后1小时开始升高,并在血液置换完成后3至6小时达到峰值,此时,血浆中Aβ浓度较基础水平升高2-3倍,直至治疗后3天恢复至基础水平。
虽然血液置换后血浆Aβ浓度升高的机制尚不清楚,但考虑到血液置换降低了大脑中Aβ的水平,研究人员推测Aβ从大脑到血液的重新分布可能就是导致血液置换可有效治疗AD的原因。
研究结果显示,即使是已发展为AD的老龄Tg2576小鼠,血液置换对于减少脑内淀粉样斑块负荷和改善空间记忆功能同样有十分明显的效果。这一结果十分有意义,因为这一治疗场景更符合临床实际情况,临床中病人也往往是在已发展为AD或大脑中淀粉样斑块已大量形成后开始进行治疗。
总的来说,本研究发现了血液置换治疗可显著降低老年Tg2576小鼠的大脑淀粉样斑块负荷,从而改善其空间记忆能力,为建立以外周循环为靶点的治疗提供了坚实基础。
尽管在临床治疗中,定期全血置换不太现实,但临床上或可通过血浆置换和血液透析来达到“清理”血液中的Aβ聚集体的效果。尤其是血液透析,其使用较为方便,若能在临床试验中进一步证实通过血液透析去除血液中Aβ可改善AD症状,那将是划时代的治疗革命。
参考文献:1. Mawuenyega KG, Sigurdson W, Ovod V, Munsell L, Kasten T, Morris JC, Yarasheski KE, Bateman RJ: Decreased clearance of CNS beta-amyloid in Alzheimer's disease. Science 2010, 330(6012):1774.doi:10.1126/science.11976232. Villeda SA, Plambeck KE, Middeldorp J, Castellano JM, Mosher KI, Luo J, Smith LK, Bieri G, Lin K, Berdnik D et al: Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice. Nat Med 2014, 20(6):659-663.doi:10.1038/nm.35693. Urayama A, Moreno-Gonzalez I, Morales-Scheihing D, Kharat V, Pritzkow S, Soto C: Preventive and therapeutic reduction of amyloid deposition and behavioral impairments in a model of Alzheimer's disease by whole blood exchange. Mol Psychiatry 2022.doi:10.1038/s41380-022-01679-44. Potter R, Patterson BW, Elbert DL, Ovod V, Kasten T, Sigurdson W, Mawuenyega K, Blazey T, Goate A, Chott R et al: Increased in vivo amyloid-beta42 production, exchange, and loss in presenilin mutation carriers. Sci Transl Med 2013, 5(189):189ra177.doi:10.1126/scitranslmed.30056155. Shibata M, Yamada S, Kumar SR, Calero M, Bading J, Frangione B, Holtzman DM, Miller CA, Strickland DK, Ghiso J et al: Clearance of Alzheimer's amyloid-ss(1-40) peptide from brain by LDL receptor-related protein-1 at the blood-brain barrier. J Clin Invest 2000, 106(12):1489-1499.doi:10.1172/JCI104986. DeMattos RB, Bales KR, Parsadanian M, O'Dell MA, Foss EM, Paul SM, Holtzman DM: Plaque-associated disruption of CSF and plasma amyloid-beta (Abeta) equilibrium in a mouse model of Alzheimer's disease. J Neurochem 2002, 81(2):229-236.doi:10.1046/j.1471-4159.2002.00889.x7. DeMattos RB, Bales KR, Cummins DJ, Dodart JC, Paul SM, Holtzman DM: Peripheral anti-A beta antibody alters CNS and plasma A beta clearance and decreases brain A beta burden in a mouse model of Alzheimer's disease. Proc Natl Acad Sci U S A 2001, 98(15):8850-8855.doi:10.1073/pnas.1512613988. Lemere CA, Spooner ET, LaFrancois J, Malester B, Mori C, Leverone JF, Matsuoka Y, Taylor JW, DeMattos RB, Holtzman DM et al: Evidence for peripheral clearance of cerebral Abeta protein following chronic, active Abeta immunization in PSAPP mice. Neurobiol Dis 2003, 14(1):10-18.doi:10.1016/s0969-9961(03)00044-59. Bu XL, Xiang Y, Jin WS, Wang J, Shen LL, Huang ZL, Zhang K, Liu YH, Zeng F, Liu JH et al: Blood-derived amyloid-beta protein induces Alzheimer's disease pathologies. Mol Psychiatry 2018, 23(9):1948-1956.doi:10.1038/mp.2017.20410. Burwinkel M, Lutzenberger M, Heppner FL, Schulz-Schaeffer W, Baier M: Intravenous injection of beta-amyloid seeds promotes cerebral amyloid angiopathy (CAA). Acta Neuropathol Commun 2018, 6(1):23.doi:10.1186/s40478-018-0511-711. Morales R, Duran-Aniotz C, Bravo-Alegria J, Estrada LD, Shahnawaz M, Hu PP, Kramm C, Morales-Scheihing D, Urayama A, Soto C: Infusion of blood from mice displaying cerebral amyloidosis accelerates amyloid pathology in animal models of Alzheimer's disease. Acta Neuropathol Commun 2020, 8(1):213.doi:10.1186/s40478-020-01087-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


