中山大学生命科学学院崔隽课题组揭示选择性自噬通过降解TBK1维持免疫平衡的新机制
来源:中山大学 2021-07-25 10:41
固有免疫是宿主防御入侵机体的病原微生物的第一道防线。感染病毒后,机体通过模式识别受体识别病毒的DNA或RNA,从而快速启动固有免疫和抗病毒反应,抑制病毒的复制,进而有效清除入侵的病毒。在感知危险信号后,调控细胞抗病毒免疫的关键激酶TBK1(TANK-binding kinase 1)被激活,并进一步磷酸化转录因子IRF3,使其入核,诱导下游干扰素的产生。TB
固有免疫是宿主防御入侵机体的病原微生物的第一道防线。感染病毒后,机体通过模式识别受体识别病毒的DNA或RNA,从而快速启动固有免疫和抗病毒反应,抑制病毒的复制,进而有效清除入侵的病毒。在感知危险信号后,调控细胞抗病毒免疫的关键激酶TBK1(TANK-binding kinase 1)被激活,并进一步磷酸化转录因子IRF3,使其入核,诱导下游干扰素的产生。TBK1是固有免疫细胞抗病毒信号通路的中心节点,如果其活性不受控制,可能导致自身免疫疾病和慢性炎症等疾病。多种翻译后修饰参与TBK1活性的调控,包括磷酸化,泛素化,SUMO化及乙酰化。崔隽教授团队曾揭示NLRP4-USP38轴能够调控TBK1通过泛素-蛋白酶体途径降解(Nature Immunology 2012; Molecular Cell 2016),然而,是否存在其他的降解系统精确调控TBK1的稳定性目前尚不明确。
细胞自噬是真核生物体内的高度保守的降解系统,能够降解细胞内有害的蛋白聚集物、老化的细胞器和侵染机体的病原微生物等,在维持机体内稳态过程中发挥不可或缺的作用。细胞自噬能够广泛地参与固有免疫过程:一方面,细胞自噬可以直接降解清除入侵的病原微生物;另一方面,选择性自噬可以通过降解抗病毒免疫网络中的核心分子,维持免疫反应的稳态。有趣的是TBK1在自噬过程中也发挥了重要的作用,它不仅可以通过促进ULK1复合体的形成促进自噬;还可以通过调节自噬识别受体的活性,促进选择性自噬。这些研究提示TBK1可能在细胞自噬和抗病毒免疫的crosstalk中发挥重要作用。
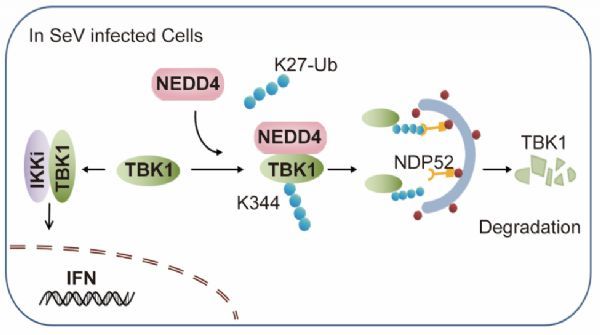
崔隽教授团队发现,NEDD4能够显着抑制抗病毒免疫反应及促进病毒复制。NEDD4在病毒感染中结合TBK1,并显着促进TBK1的降解,但是在无病毒侵染时,NEDD4不影响TBK1的稳定性。进一步研究发现这是由于NEDD4主要靶向磷酸化的TBK1(p-TBK1),并促使p-TBK1发生自噬降解。当TBK1的磷酸化位点(S172)突变后,NEDD4不再能够与之结合并促进其发生自噬降解。NEDD4促使激活的TBK1在K344位点发生K27类型的泛素化修饰。选择性自噬识别受体NDP52通过K27类型的泛素链识别TBK1并将其输送至自噬溶酶体中进行降解。以往的研究表明在病毒侵染的早期,TBK1会发生K48类型的泛素修饰,进而通过泛素-蛋白酶体途径降解。该研究进一步揭示在病毒侵染的后期,激活的TBK1主要发生K27类型的泛素修饰,使得TBK1通过选择性自噬降解途径进一步降解,防止TBK1被过度激活。因此,NEDD4介导的TBK1的自噬降解对于维持抗病毒免疫平衡具有重要的作用。
该研究成果“Selective autophagy controls the stability of TBK1 via NEDD4 to balance host defense”发表在Cell Death & Differentiation杂志上。该研究揭示了NEDD4通过介导磷酸化的TBK1发生K27类型的泛素化修饰,进而使其被货物受体NDP52识别并运输至自噬溶酶体中降解,从而防止TBK1过度激活,维持机体免疫平衡的新机制。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->