《癌细胞》:癌症免疫治疗重大发现!科学家首次证实,癌细胞PD-L1不抑制T细胞毒性,而是抑制T细胞浸润转移灶,促进癌症转移
来源:奇点糕 2023-03-23 10:36
这篇论文有两个出人意料的新发现:第一,肿瘤细胞PD-L1竟然不直接抑制细胞毒性T细胞的毒性;第二,肿瘤细胞PD-L1对肿瘤原发灶没有保护作用,而是通过与转移灶髓系细胞PD-1结合
在PD-1/PD-L1抑制剂使用了近10年的今天,科学家竟然还能围绕PD-L1,发现刷新认知级别的新机制。
近日,由美国乔治亚医学院Liu Kebin教授领衔的研究团队,在著名期刊《癌细胞》上发表了一项重大研究成果[1]。
这篇论文有两个出人意料的新发现:第一,肿瘤细胞PD-L1竟然不直接抑制细胞毒性T细胞的毒性;第二,肿瘤细胞PD-L1对肿瘤原发灶没有保护作用,而是通过与转移灶髓系细胞PD-1结合,抑制细胞毒性T细胞对转移灶的浸润,促进转移灶肿瘤的生长。

论文首页截图
时至今日,我们都知道,免疫检查点抑制剂主要是通过阻断PD-1/PD-L1信号通路,发挥抗癌作用的。其中,PD-1指的主要是细胞毒性T细胞表面的PD-1,而PD-L1主要是癌细胞表面的PD-L1[2]。
目前对PD-1及其下游信号通路功能的争议较小,然而,究竟是谁的PD-L1在通过PD-1影响T细胞的活性,目前仍存在争议。
大量基于小鼠模型的研究发现,树突状细胞和巨噬细胞等免疫细胞的PD-L1,在抑制T细胞抗肿瘤反应中发挥了主导作用[3];仅有一项研究发现,肿瘤细胞PD-L1(tPD-L1)足以抑制细胞毒性T细胞的毒性,以促进结肠癌小鼠模型的肿瘤免疫逃逸[4]。然而,人体临床研究却发现,肿瘤细胞PD-L1或者肿瘤细胞联合免疫细胞PD-L1才是预后的最强指标[5,6]。
在Liu教授看来,小鼠研究结果之所以与临床研究不符,可能是因为肿瘤的解剖位置不同。在临床前研究中,导致小鼠死亡的大多是类似于原发肿瘤的肿瘤负担过高;而癌症患者的死亡,主要是癌症转移导致的。因此,肿瘤细胞PD-L1对于癌症的转移可能有不为人知的重要作用。
为了搞清楚肿瘤细胞PD-L1的功能,Liu教授团队选用了4种表达PD-L1的癌细胞系:三阴性乳腺癌细胞系4T1,微卫星稳定型肠癌细胞系CT26,转移性微卫星不稳定肠癌细胞系MC38-met,黑色素瘤细胞系B16-F10。他们还基于上述4个细胞系,构建了一一对应的PD-L1敲除癌细胞系。
他们将上述8种细胞系分别与一个细胞毒性T细胞系混合培养,发现T细胞对所有癌细胞系都显示出剂量依赖的细胞毒性,而且T细胞和正常癌细胞系共培养还会导致双方的PD-1和PD-L1表达水平上升。他们还发现,PD-L1的表达对癌细胞竟然没有保护作用,甚至加入PD-1抑制剂也没有保护作用。
Liu教授认为,这说明在不存在肿瘤微环境的情况下,癌细胞和T细胞1V1的时候,表不表达PD-L1对癌细胞来说是一样的。其实这还暗示,肿瘤细胞PD-L1与T细胞PD-1之间的互作,可能不影响T细胞的毒性。
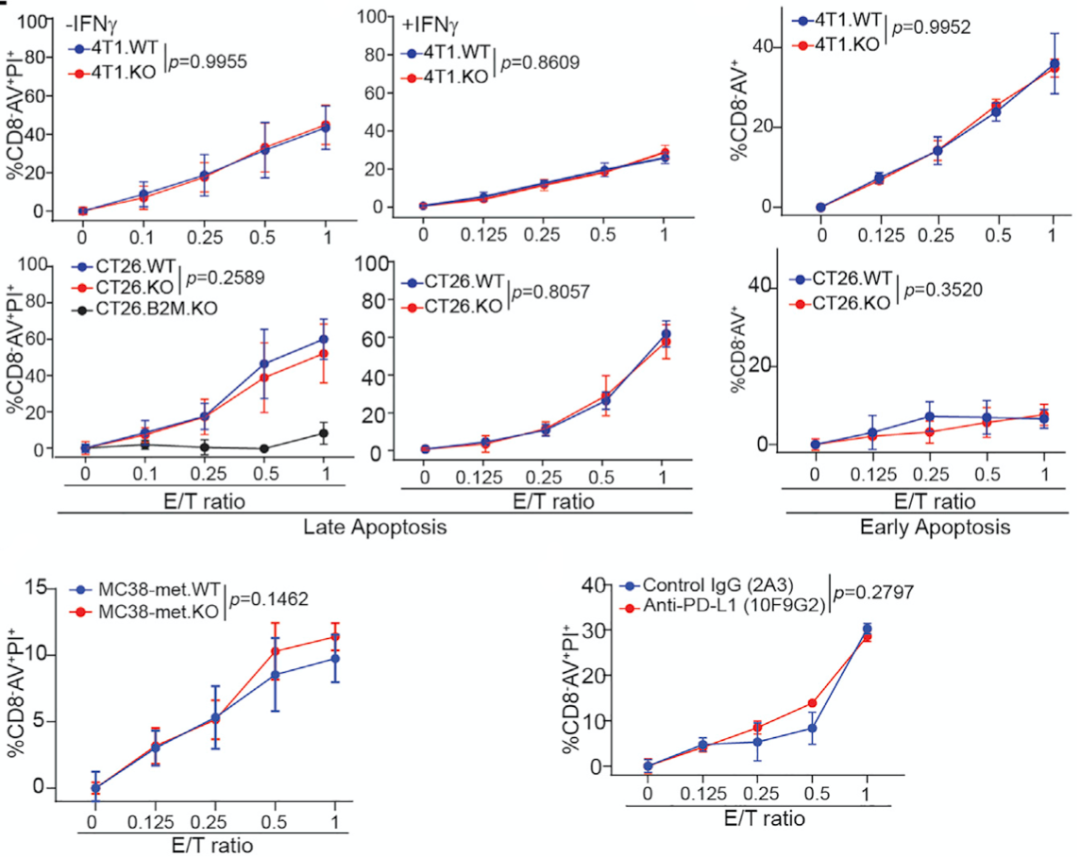
肿瘤细胞的PD-L1在体外没有保护作用
那么这种现象在体内是不是也存在呢?
没想到真存在。
无论是将哪对细胞系注射到小鼠体内,PD-L1存在与否都不影响肿瘤的大小。这再次说明,肿瘤细胞PD-L1对原发肿瘤的生长没有帮助。这确实刷新了我的认知!
接下来Liu团队以三阴性乳腺癌4T1(可自发发生肺转移)为例,探索了肿瘤细胞PD-L1对癌症转移的影响。他们发现,在小鼠乳腺分别接种两种癌细胞后,表达PD-L1的肿瘤细胞肺部转移灶更多,肿瘤负担更重,而PD-L1被敲除的4T1细胞的肺转移能力明显被削弱。在其他几个细胞系中,也发现了类似的现象。
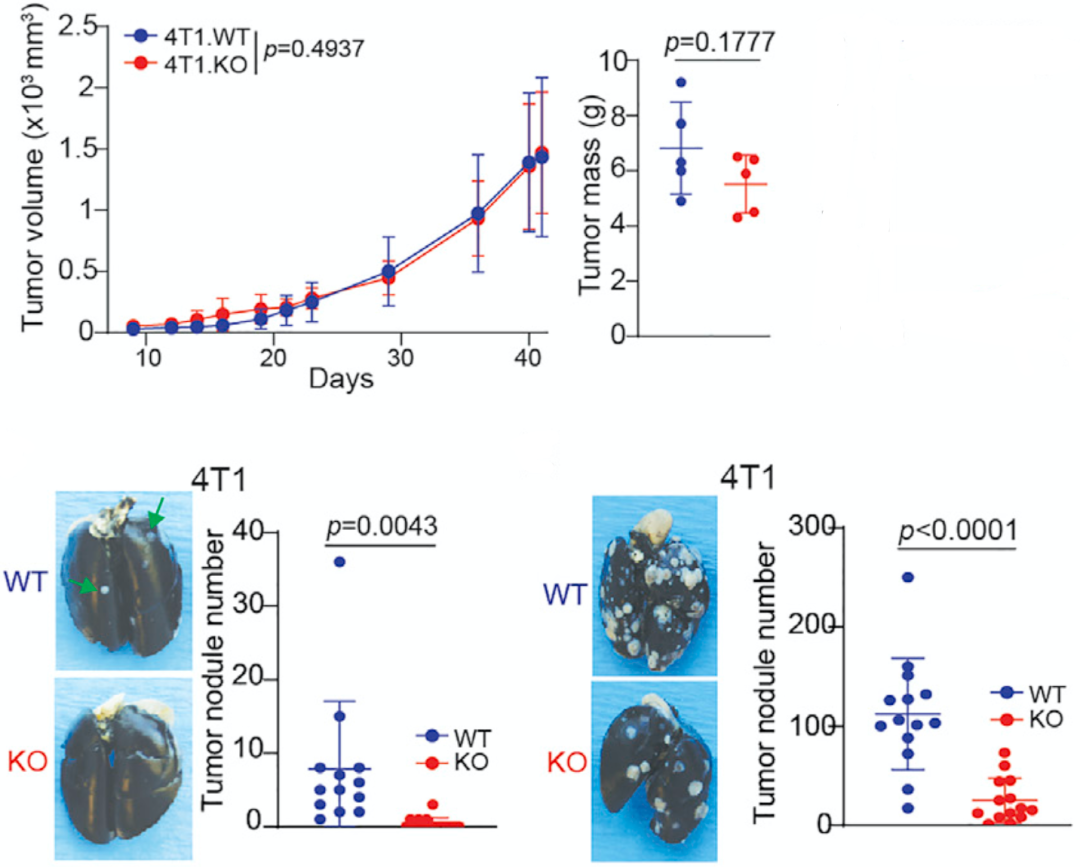
肿瘤细胞PD-L1不影响原发瘤生长,而影响转移瘤的生长
在随后的研究中,Liu团队证实,虽然肿瘤细胞PD-L1不保护原发灶,但是髓系细胞表面的PD-L1确实是在保护原发灶。这一发现很好地解释了前面的人鼠差异。
确定肿瘤细胞PD-L1促进转移且不保护原发灶之后,Liu团队要解决的问题是,肿瘤细胞的PD-L1究竟是如何促进癌细胞转移的。
为了回答这个问题,他们首先比较了PD-L1表达状态对原发灶和转移灶肿瘤微环境的影响。结果发现,在接种后1天后,无论PD-L1是否敲除,小鼠肺部的初始癌细胞没有差异。他们还注意到,相比正常的4T1,PD-L1被敲除的4T1肺部转移灶CD3阳性细胞浸润增加,但是原发灶没有;如果清除小鼠体内的免疫细胞,那无论PD-L1表达与否,都能形成同样的肺转移灶。
这些数据说明,肿瘤细胞PD-L1并不影响癌细胞的散播,而是帮助转移灶的癌细胞躲避细胞毒性T细胞的杀伤。
这又是如何实现的呢?
经过一系列复杂的实验,Liu团队发现转移灶肿瘤细胞PD-L1与髓系细胞PD-1(mPD-1)结合后,会激活SHP2,下调IFN-I→STAT1→CXCL9这条会招募细胞毒性T细胞的信号通路,进而抑制T细胞对转移灶的浸润,而不是通过PD-1/PD-L1通路抑制了T细胞的杀伤力。
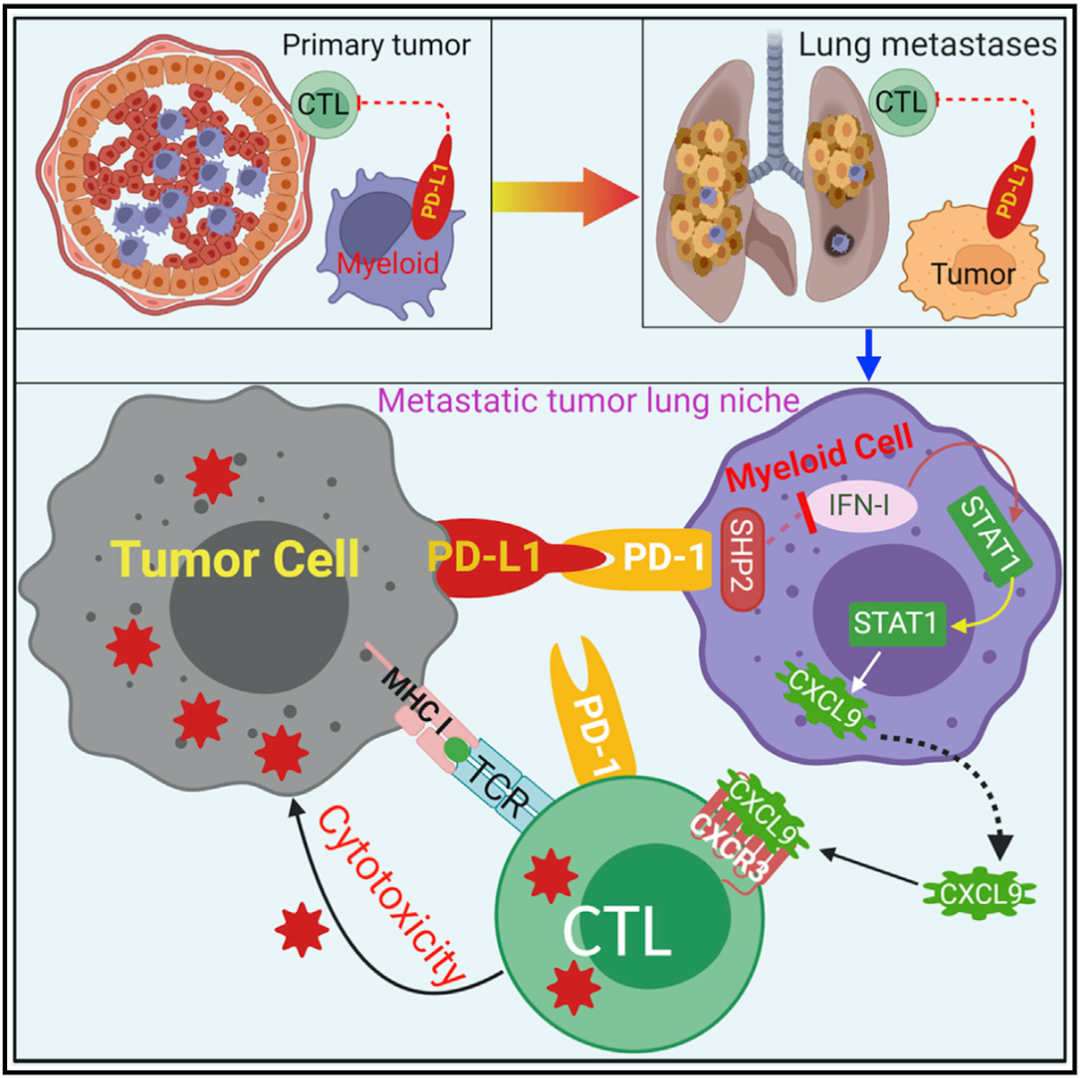
机制示意图
总的来说,Liu教授团队的这项研究成果让我们对癌症免疫有了全新的认知。让我们知道,原来PD-1/PD-L1这条信号通路远比我们想想的复杂,它的功能不仅与细胞类型有关,而且还与肿瘤的解剖部位有关。
更重要的是,这个研究让我们对免疫新辅助和辅助治疗有了更深的理解,也夯实了这两种疗法的理论基础。
参考文献:
[1].Klement JD, Redd PS, Lu C, et al. Tumor PD-L1 engages myeloid PD-1 to suppress type I interferon to impair cytotoxic T lymphocyte recruitment. Cancer Cell. 2023;41(3):620-636.e9. doi:10.1016/j.ccell.2023.02.005
[2].Tumeh PC, Harview CL, Yearley JH, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 2014;515(7528):568-571. doi:10.1038/nature13954
[3].Oh SA, Wu DC, Cheung J, et al. PD-L1 expression by dendritic cells is a key regulator of T-cell immunity in cancer. Nat Cancer. 2020;1(7):681-691. doi:10.1038/s43018-020-0075-x
[4].Juneja VR, McGuire KA, Manguso RT, et al. PD-L1 on tumor cells is sufficient for immune evasion in immunogenic tumors and inhibits CD8 T cell cytotoxicity. J Exp Med. 2017;214(4):895-904. doi:10.1084/jem.20160801
[5].Yoon HH, Jin Z, Kour O, et al. Association of PD-L1 Expression and Other Variables With Benefit From Immune Checkpoint Inhibition in Advanced Gastroesophageal Cancer: Systematic Review and Meta-analysis of 17 Phase 3 Randomized Clinical Trials. JAMA Oncol. 2022;8(10):1456-1465. doi:10.1001/jamaoncol.2022.3707
[6].Zou Y, Zou X, Zheng S, et al. Efficacy and predictive factors of immune checkpoint inhibitors in metastatic breast cancer: a systematic review and meta-analysis. Ther Adv Med Oncol. 2020. doi:10.1177/1758835920940928
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


