Immunity | 外周“血管树”而非骨髓内皮细胞对于维持非经典单核细胞的存活和稳态必不可少
来源:生物探索 2024-08-13 13:54
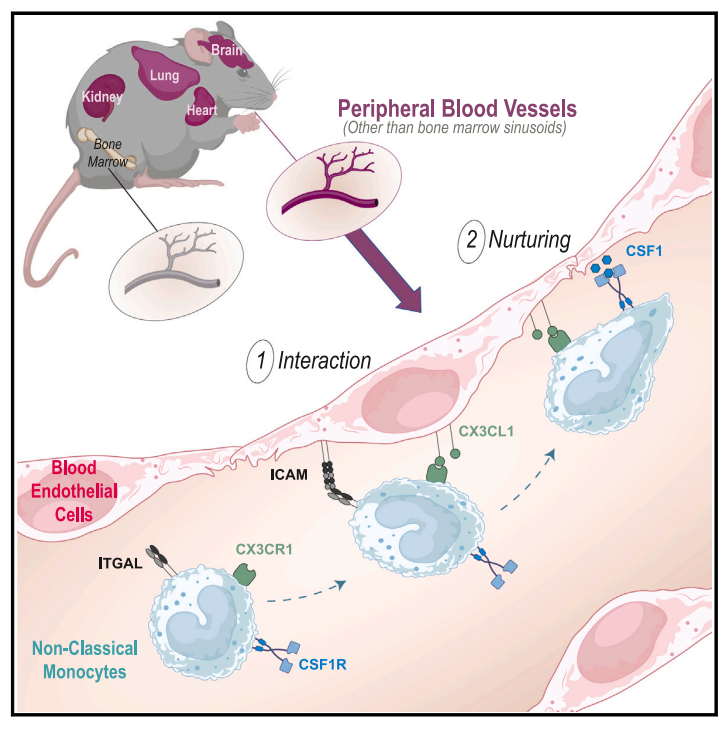
本研究证明大多数器官和血管中内皮细胞表达的CSF1和CX3CL1对于维持NCM的存活和稳态是必需的,而骨髓内皮细胞中CSF1表达却并非必需,修改并补充了之前提出的关于NCM稳态维持的模型。
与组织驻留巨噬细胞相似,非经典单核细胞(non-classical monocytes, NCM)也具有免疫监视和组织修复等功能,可在血管管腔侧巡逻以清除受损细胞和碎片,但高度活动的NCM是否也依赖于专门的“生态位”来实现其发育和稳态仍不清楚。除了血管,NCM还存在于高度血管化的器官如脾、肺和骨髓,最近的研究表明,NCM的稳态与骨髓正弦内皮细胞产生集落刺激因子1(CSF1)的能力有关【1, 2】,但其他细胞来源的CSF1或其他潜在因素对于NCM稳态的影响仍然未知。
近日,来自法国艾克斯·马赛大学的Marc Bajenoff团队在Immunity杂志上发表了一篇题为Non-classical monocytes scavenge the growth factor CSF1 from endothelial cells in the peripheral vascular tree to ensure survival and homeostasis的文章,他们证明大多数器官和血管中内皮细胞表达的CSF1和CX3CL1对于维持NCM的存活和稳态是必需的,而骨髓内皮细胞中CSF1表达却并非必需,修改并补充了之前提出的关于NCM稳态维持的模型。

为确认外周内皮细胞是否与骨髓内皮细胞执行相同的功能【1, 2】,他们生成了内皮细胞csf1条件性敲除的小鼠(Tie2ΔCsf1),与对照相比,该小鼠经典单核细胞(CM)没有改变,但NCM急剧减少,这种减少可能由于csf1缺乏直接影响NCM生存,也可能由于NCM分化为组织驻留巨噬细胞。通过对小鼠多个组织器官巨噬细胞的分析,排除了后一可能性,有趣的是,皮下注射重组CSF1-Fc 融合蛋白则能诱导Tie2ΔCsf1小鼠循环NCM增加60倍。之前的工作表明CX3CR1信号传导可促进单核细胞的体外粘附和存活,CX3CR1缺陷小鼠表现出NCM水平下降,为确定CX3CR1来源,他们再次生成了内皮细胞Cx3cl1条件性敲除小鼠,观察到血液、脾脏和肺中的中间单核细胞和 NCM 均显着减少,足以对Cx3cr1缺陷小鼠进行表型复制。
由于CX3CL1 的趋化粘附特性,该团队推测CX3CL1可能赋予NCM更强的摄取生长因子CSF1的能力。CSF1R(表达与单核细胞表面)与CSF1结合可诱导激活受体的快速内化和溶酶体降解,与对照小鼠相比,从Tie2ΔCsf1小鼠血液中分离出的循环NCM上的表面CSF1R富集,说明可用CSF1R的表面表达来推断NCM摄取CSF1的量。
基于此,该团队对Cx3cr1正常或缺乏受体小鼠进行辐照后移植tdT+ Cx3cr1骨髓,一个月后检测循环NCM表达CSF1R表达及其Csf1r mRNA表达水平。在WT=>WT嵌合体中受体和供体来源NCM的CSF1R和Csf1r mRNA转录本表达相似,相反,在WT=>KO嵌合体中,CSF1R mRNA转录物水平相似,但供体NCM表面的CSF1R蛋白少于受体(Cx3cr1缺乏),这些结果提示NCM与内皮的粘附促进内皮CSF1的摄取,并最终促进它们的存活。
模式图(Credit: Immunity)
综上,这项工作进一步补充了调节NCM稳态的机制,整个“血管树”而非仅仅是骨髓内皮细胞都可充当NCM的生态位。
参考文献:
1. Emoto, T., Lu, J., Sivasubramaniyam, T., Maan, H., Khan, A.B., Abow, A.A., Schroer, S.A., Hyduk, S.J., Althagafi, M.G., McKee, T.D., et al. (2022). Colony stimulating factor-1 producing endothelial cells and mesenchymal stromal cells maintain monocytes within a perivascular bone marrow niche. Immunity 55, 862–878.e8.
2. Zhang, J., Wu, Q., Johnson, C.B., Pham, G., Kinder, J.M., Olsson, A., Slaughter, A., May, M., Weinhaus, B., D’Alessandro, A., et al. (2021). In situ mapping identifies distinct vascular niches for myelopoiesis. Nature 590, 457–462.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


