DLC1 的肿瘤抑制活性需要其 START 域与磷脂酰丝氨酸、PLCD1 和 Caveolin 1 相互作用
来源:本站原创 2021-11-19 12:37
DLC1是一种肿瘤抑制基因,在许多癌症类型中通过遗传和非遗传机制下调,其编码的蛋白RhoGAP和支架活性有助于其肿瘤抑制功能。
DLC1是一种肿瘤抑制基因,在许多癌症类型中通过遗传和非遗传机制下调,其编码的蛋白RhoGAP和支架活性有助于其肿瘤抑制功能。DLC1 START(StAR 相关脂质转移;DLC1 START)域的作用,除了与 Caveolin 1 的结合外,还知之甚少。 在其他 START 域中,一个关键功能是它们结合脂质,但 DLC1 START 的假定脂质配体未知。
脂质叠加分析和磷脂酰丝氨酸 (PS) 下拉分析证实了 DLC1 START 与 PS 的结合。 共免疫沉淀研究证明了 DLC1 START 和磷脂酶 C delta 1 (PLCD1) 或 Caveolin 1 之间的相互作用,以及 PS 对这些相互作用的贡献。Rho GTP、细胞增殖、细胞迁移和/或贴壁独立生长测定用于研究 PS 和 PLCD1 的贡献,或
TCGA 癌症相关 DLC1 START 突变体对 DLC1 功能的影响。利用Co免疫沉淀和PS拉下试验研究DLC1
START突变体功能受损的分子机制。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34727930/
DLC1是一种肿瘤抑制基因,最初发现它是因为在肝癌中缺失,后来发现它通过遗传、表观遗传和翻译后机制在许多其他类型的肿瘤中下调,包括结肠/直肠、乳腺、前列腺和肺。肿瘤中DLC1的下调主要归因于基因缺失或启动子DNA甲基化,尽管其他变化也可能导致其表达减少。最近,对 TCGA 数据集中几种肿瘤类型的精细分析表明,DLC1 中的肿瘤相关点突变也经常发生,并且可以通过多种机制损害其编码蛋白的生物学功能。
DLC1编码一个多结构域蛋白,包括n端一个不育α基序(SAM)、Rho GTPase激活蛋白(RhoGAP)结构域和c端一个star相关脂质转移(START)结构域。RhoGAP 结构域通过促进活性 Rho-GTP 转化为非活性 Rho-GDP 来负调节 Rho 活性,这最初被假设为 DLC1 的肿瘤抑制功能的唯一基础,通过重塑细胞骨架和抑制肿瘤生长和细胞迁移。
然而,DLC1也是一种支架蛋白,它与其他蛋白(如张力蛋白)的相互作用可以以rhogap无关的方式促进DLC1的抑癌活性。此外,在非小细胞肺癌细胞系中,gap死亡的DLC1突变体仍可部分抑制锚定非依赖性生长,而在NIH3T3成纤维细胞中,DLC1的非活性形式可部分抑制细胞迁移。综上所述,这些发现导致结论,DLC1通过gap独立机制发挥其肿瘤抑制作用。此外,DLC1的活性也会在翻译后受到影响,因为包括PKA、AKT和SRC在内的一些激酶会磷酸化并最终影响DLC1的抑癌活性。
在当前的研究中,作者关注 DLC1 START 域 (DLC1-START) 对 DLC1 全部活性的贡献,基于以下假设:DLC1 与其他大分子通过其 RhoGAP 域以外的区域的相互作用可能会揭示新的 DLC1 支架功能可以调节其肿瘤抑制活性,可能以独立于 RhoGAP 的方式。
START结构域通常存在于脂质转运蛋白中,在脂质生物学的多个方面发挥着不同的作用,包括脂质运输、脂质代谢和信号事件的调节。只有少数家族成员知道与每个START结构域结合的脂类的身份,到目前为止,还没有发现脂类与DLC1或DLC家族的其他成员(DLC2和DLC3)的START结构域结合。此外,除了DLC1-START与Caveolin-1的相互作用外,未发现与该区域相关的其他功能相互作用。因此,DLC1-
start的功能及其对DLC1功能的贡献在很大程度上尚不明确。
在非小细胞肺癌细胞中,小泡的主要成分小泡蛋白-1通过与DLC1- start中缺失氨基酸929 - 957而减少结合的区域相互作用,与DLC1形成功能复合物。研究发现,DLC1与Caveolin-1的相互作用对DLC1抑制迁移和锚定依赖性生长至关重要,但并不影响DLC1 RhoGAP活性,这是RhoGAP不依赖于DLC1抑癌机制的另一个例子。此外,对癌症基因组图谱数据库 (TCGA) 结直肠癌相关 DLC1 突变体 (E966K) 的实验分析,其突变与 DLC1-START 中的 929 957 缺失相邻,对这些结果进行表型复制,因为它编码的蛋白质缺乏
与细胞中的 Caveolin-1 结合并显示出受损的 DLC1 肿瘤抑制活性(细胞迁移和不依赖锚定的生长)而不影响其 RhoGAP 活性。
假设的简化图形总结。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34727930/
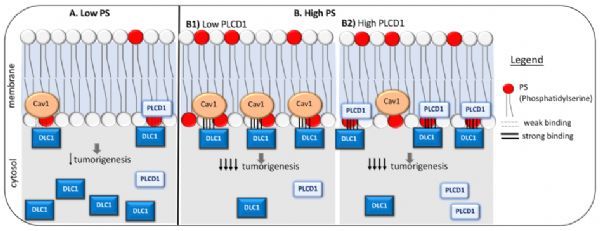
作者鉴定出PS是DLC1 START的脂质配体,并确定DLC1 START除了与Caveolin 1结合外,还与PLCD1蛋白结合。PS结合促进了DLC1与Caveolin 1和PLCD1的相互作用。作者对7个与肿瘤相关的DLC1 START突变体的分析支持了这些活性在肿瘤发生中的重要性,每个突变体都降低了肿瘤抑制功能,但保留了野生型RhoGAP活性。
作者对DLC1 START的结构模型表明,突变体扰乱了结构内的不同元素,这与作者的实验结果相关联,突变体是异质性的,缺乏适当的结合纽带。有些减少了PS的结合,有些减少了PLCD1和Caveolin
1的结合,还有一些缺乏所有这些特性。(生物谷 Bioon.com)
参考文献
Beatriz Sanchez‑Solana et al. The tumor suppressor activity of DLC1 requires the
interaction of its START domain with Phosphatidylserine, PLCD1, and Caveolin-1.
Mol Cancer 2021 Nov 2;20(1):141. doi: 10.1186/s12943-021-01439-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。