“忠诚”的免疫系统怎会误伤“友军”?Cell:发现补体激活的25纳米“临界点”,破解纳米药物被免疫攻击之谜
来源:生物谷原创 2025-06-30 11:52
这项研究为我们揭开了补体系统与材料表面相互作用的神秘面纱,发现了补体激活存在一个由表面蛋白间距决定的渗透型临界点,这一关键发现让我们对补体系统的 “决策” 机制有了全新的认知。
在当今这个科技飞速发展的时代,纳米技术已经渗透到我们生活的方方面面,从日常的防晒霜到先进的医疗设备,甚至是新冠疫情期间广泛使用的纳米疫苗。然而,这些微小的纳米颗粒在人体内的行为却远比我们想象的复杂。我们都知道,人体免疫系统是守护健康的忠诚卫士,但有时它也会 “误判形势”,将本应是“友军”的纳米药物或医疗设备视为外敌,发起攻击,导致炎症等不良反应。今天,我们要深入探讨的,就是免疫系统中补体系统与进入人体的材料之间那场微妙而关键的 “交锋”,揭秘它们之间相互作用的奥秘。
这项研究聚焦于补体系统,这是一个由约 40 种血液蛋白组成的复杂网络,它能识别并标记微生物、纳米颗粒以及医疗设备等,启动炎症反应。尽管补体系统在抵御病原体方面功不可没,但它对纳米药物、基因治疗载体、医疗设备甚至自身细胞的攻击,也给我们带来了诸多困扰。以往我们对补体系统为何会 “青睐” 某些表面而 “忽视” 另一些表面知之甚少。
而这项研究的亮点就在于,它通过巧妙的实验设计和先进的计算模型,揭示了补体激活存在一个关键的 “临界点”,即材料表面潜在补体附着位点的密度,这一发现不仅让我们对补体系统的 “决策” 机制有了全新的认识,还为设计能够避免补体激活的工程表面提供了理论依据,有望改善纳米药物的疗效并减少相关副作用,意义非凡。相关研究成果发表于《细胞》杂志上。

实验对象与流程
研究者们选择了多种实验对象,包括具有临床应用潜力的脂质体纳米颗粒、大肠杆菌以及 DNA 折纸构建的平面结构等,以从不同角度剖析补体系统与材料表面的相互作用。以脂质体纳米颗粒为例,实验流程如下:
首先,研究团队通过改变与脂质体表面结合的免疫球蛋白 G(IgG)的数量,精确调控纳米颗粒表面潜在补体附着位点的间距。接着,将这些具有不同蛋白间距的脂质体纳米颗粒通过静脉注射的方式给予小鼠,并在小鼠体内引发急性全身性炎症反应(通过注射细菌内毒素脂多糖 LPS 实现)。一段时间后,研究人员收集小鼠的各个器官组织以及血液样本,利用流式细胞术、荧光光谱分析、酶联免疫吸附试验(ELISA)等多种技术手段,检测纳米颗粒在体内的分布情况、与白细胞的相互作用以及补体激活所产生的多种产物,如 C3a、C5a 等,并评估可能出现的溶血等副作用。同时,还在体外进行了补充实验,将蛋白脂质体与血清共孵育,通过流式细胞术和纳米颗粒追踪分析(NTA)等技术,检测补体蛋白 C3b 在纳米颗粒表面的沉积情况,以此来揭示补体系统对不同表面蛋白间距的响应规律。
实验结果与讨论
实验结果令人瞩目且富有启发性。在体内实验中,研究者们发现脂质体纳米颗粒表面的蛋白间距对纳米颗粒在小鼠体内的分布和引发的副作用存在显著影响。当脂质体表面每颗粒子的 IgG 数量超过 100 个时,即蛋白间距小于等于约 25 纳米时,纳米颗粒在炎症小鼠的肺部积累浓度显著升高,而在其他器官并未观察到这种阈值效应。
进一步的流式细胞术分析表明,这种肺部摄取的增加是由于纳米颗粒被白细胞识别的结果,且当表面蛋白间距从 36 纳米缩小至 18 纳米时,纳米颗粒与白细胞的关联程度大幅提升了 10 倍。此外,补体激活引发的副作用如溶血,以及血浆中 C3a 水平等指标的变化,也呈现出与纳米颗粒肺部摄取相似的阈值现象,均在蛋白间距小于等于约 25 纳米时急剧增加,这充分表明了补体系统的激活与材料表面蛋白间距之间存在着紧密的关联。
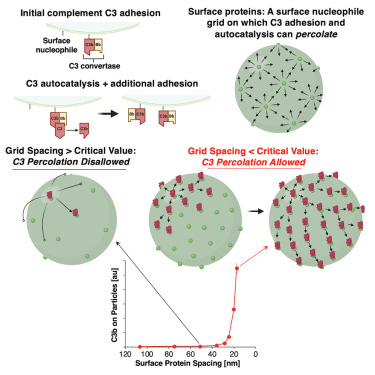
在体外实验中,针对补体蛋白 C3b 在纳米颗粒表面的沉积情况,同样发现了锐利的阈值。随着纳米颗粒表面蛋白间距的减小,C3b 沉积量在蛋白间距小于等于约 28 纳米时急剧上升。有意思的是,这种平均值的上升并非源于所有纳米颗粒表面 C3b 的均匀沉积,而是部分纳米颗粒出现了高 C3b 沉积,而另一部分则沉积较少。当表面蛋白间距小于阈值时,只有部分纳米颗粒会经历彻底的 C3b 涂层,这种现象暗示着补体激活过程中存在着某种概率性的“失控事件”。
为了验证这一猜想,研究人员采用第二种单颗粒检测技术,即利用荧光标记的重组 C3 蛋白与蛋白脂质体共孵育,通过纳米颗粒追踪分析(NTA)定量检测带有荧光 C3 的蛋白脂质体。结果再次证实了之前的发现,即当表面蛋白间距小于 25 纳米时,C3 在纳米颗粒表面的沉积量急剧增加,且与流式细胞术检测到的 C3b 沉积模式高度一致。基于这些实验现象,研究人员提出了一个可能的机制:初始的 C3b 可以通过 “自发 tick-over” 作用(由 C3(H2O)Bb 生成)黏附到表面蛋白上,形成的 C3b-表面加合物能够催化产生新的 C3b 分子。如果相邻的黏附位点距离较近(小于 25 纳米),新生成的可溶性 C3b 能够在 thioester 水解前扩散并黏附到附近的表面蛋白上,从而引发一系列连锁反应,使得 C3b 在纳米颗粒表面不断扩散,最终导致整个纳米颗粒被 C3b 完全覆盖,形成所谓的 “失控事件”。而当表面蛋白间距较大时,可溶性 C3b 的 thioester 会在找到下一个黏附位点之前水解,从而阻止了 C3b 的进一步扩散和补体激活。
此外,研究人员还在多种水平的补体信号级联中探究了这种锐利阈值现象的存在情况。除了 C3b 沉积外,他们还测定了溶液相产物 C3a 和 C5a 以及表面结合蛋白 properdin 的水平。结果发现,对于依赖表面加合物形成的补体产物如 C5a 和 properdin,在对表面蛋白数量进行归一化处理后,仍然存在明显的阈值现象。而 C3a 由于其产生不依赖于表面加合物的稳定性,在归一化后阈值效应消失。这进一步证实了补体激活的阈值关键取决于补体-表面加合物的形成和稳定性。
为了进一步验证补体系统对表面蛋白间距的响应是否具有普遍性,研究人员还研究了大肠杆菌表面的补体反应。他们通过使用甲基封端的聚乙二醇链阻断大肠杆菌表面的亲核基团,有效增加了表面蛋白之间的平均间距。实验结果显示,当大肠杆菌表面的有效蛋白间距减小时,补体反应显著增强,C3a 的产生以及 C3b 在细菌表面的沉积均呈现出与纳米颗粒实验中相似的阈值效应,尽管由于细菌表面多糖可激活凝集素途径等原因,其具体阈值和曲线形态与纳米颗粒略有差异,但整体模式一致,表明补体系统对表面蛋白密度的敏感性在不同生物材料中具有共性。
在 DNA 折纸实验中,研究人员通过精确控制 DNA 折纸上 IgG 蛋白的位置和间距,进一步证实了固定蛋白间距对补体反应的调控作用。实验发现,在相同数量的蛋白存在于 DNA 折纸上时,改变表面蛋白之间的分子间距显著改变了补体对折纸表面的反应。例如,与间距较大的 73×40 纳米的蛋白排列相比,间距较小的 31×20 纳米和 73×20 纳米的蛋白排列诱导了更高水平的替代途径 C3a 产生和 C3b 黏附,这再次凸显了表面蛋白间距在补体激活中的关键作用。
计算模型与深入分析
最后,研究人员还构建了常微分方程(ODE)模型和基于代理的晶格模型(ABM),以深入理解补体激活阈值现象。ODE模型涵盖替代途径的所有相关反应,成功预测了C3a产生和C3b表面黏附与蛋白间距的曲线关系,呈现出与实验相似的阈值。ABM模型则聚焦于单个纳米颗粒表面的C3-C表面相互作用和自催化过程,显示当补体附着位点间距小于阈值时,会出现“C3b扩散”和“失控事件”,即C3b从一个附着位点迅速扩散到邻近位点,最终覆盖整个纳米颗粒表面。
通过对ODE模型中的反应进行分组和简化,研究人员发现了一个包含三个关键物种浓度的最小子网络,其在数学形式上与目标细胞-感染细胞-病毒载量(TIV)模型相似,而TIV模型又与易感者-感染者-康复者(SIR)疾病传播模型具有相同的动态特性,均属于渗透通用类模型。在ABM模型中,研究人员观察到了渗透型临界点的四个标志,这些分析有力地证明了补体系统中存在渗透型临界点,材料表面的蛋白间距作为控制参数,其变化可引发补体激活的急剧转变,从而解释了实验中观察到的阈值现象。
小结
综上,这项研究为我们揭开了补体系统与材料表面相互作用的神秘面纱,发现了补体激活存在一个由表面蛋白间距决定的渗透型临界点,这一关键发现让我们对补体系统的 “决策” 机制有了全新的认知。从纳米尺度的单个纳米颗粒表面 C3b 沉积到宏观尺度的动物病理反应,这种临界现象贯穿多个尺度,影响深远。它不仅让我们明白了为何某些材料会遭受补体系统的 “攻击”,更为设计能够逃避补体识别的生物材料指明了方向,有望在未来改善纳米药物的疗效和安全性,减少医疗设备相关的炎症并发症。(生物谷Bioon.com)
参考文献:
Zhicheng Wang et al, A percolation phase transition controls complement protein coating of surfaces, Cell (2025). DOI: 10.1016/j.cell.2025.05.026.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


