PNAS:增加HtrA1基因表达有潜力治疗老年性黄斑变性
来源:本站原创 2021-07-27 09:40
2021年7月27日讯/生物谷BIOON/---老年性黄斑变性(AMD)是全世界不可逆转失明的一个主要原因,也是55岁及以上美国人失明的主要原因。在一项新的研究中,来自美国犹他大学的研究人员解释了为什么携带与老年性黄斑变性(AMD)产生密切相关的一组基因变异的人可能会患上这种疾病,并确定了减缓甚至逆转疾病进展的潜在治疗途径。相关研究结果发表在2021年7月2
2021年7月27日讯/生物谷BIOON/---老年性黄斑变性(AMD)是全世界不可逆转失明的一个主要原因,也是55岁及以上美国人失明的主要原因。在一项新的研究中,来自美国犹他大学的研究人员解释了为什么携带与老年性黄斑变性(AMD)产生密切相关的一组基因变异的人可能会患上这种疾病,并确定了减缓甚至逆转疾病进展的潜在治疗途径。相关研究结果发表在2021年7月27日的PNAS期刊上,论文标题为“Chromosome 10q26–driven age-related macular degeneration is associated with reduced levels of HTRA1 in human retinal pigment epithelium”。论文通讯作者为犹他大学转化医学中心执行主任Gregory S. Hageman博士和犹他大学转化医学中心的Brandi L. Williams博士。

经过15年多的研究,这些作者采用了大量捐赠的人类眼部组织,发现HtrA1蛋白通常在眼睛的视网膜色素上皮(RPE)-布鲁赫膜(Bruch's membrane)界面随着年龄的增长而增加,帮助维持这个区域的正常功能。视网膜色素上皮是一个细胞层,为视网膜的光敏感光细胞输送营养并清除废弃物。
这些新数据显示在位于10号染色体的AMD相关风险变异的个体中,情况并非如此。这些变异被发现损害了视网膜色素上皮中的HTRA1基因表达,导致视网膜色素上皮-布鲁赫膜界面的HtrA1蛋白水平在衰老过程中减少了约50%。未能产生足够水平的HtrA1蛋白扰乱了眼睛的这一关键区域,并与AMD相关病症有关,包括异常堆积物沉积和异常血管的产生。这些发现首次解释了HtrA1在维持眼部健康方面的重要作用,并与之前由其他人发表的文献相矛盾。它们预计将为10号染色体相关的AMD开发新型疗法提供信息。
Williams博士说,她的团队发现视网膜色素上皮中的HTRA1 mRNA和视网膜色素上皮-布鲁赫膜界面上分泌的HtrA1蛋白水平明显降低。发现HTRA1的表达减少是风险等位基因特异性的,但仅在视网膜色素上皮中,而不是在神经视网膜或脉络膜中。值得注意的是,该团队还将AMD相关的10号染色体的一个大的遗传区域缩小到一个小得多的存在因果关系的区域,该区域可能引发HTRA1表达的减少。
Williams说,“我们的发现是有意义的,因为它们表明HtrA1在衰老过程中正常维持视网膜色素上皮-布鲁赫膜界面的完整性,本质上就是周转细胞外物质并防止异常沉积物---包括基底层沉积物---在视网膜色素上皮和布鲁赫膜之间积累。早期未发表的犹他大学转化医学中心研究记录了10号染色体与基底层沉积物的形成之间的重要关联性。将HtrA1看作是保护性的,这与人们的期望相反,因为HtrA1蛋白的升高被认为是一些疾病(如骨关节炎)的一个诱因。”
获得一个由8000多对捐赠的人眼组成的独特存储库对这项研究至关重要,因为没有动物模型能准确地模拟10号染色体相关的AMD的生物学特性。这一关键资源使Williams团队能够比较HTRA1在来自具有和不具有10号染色体相关风险基因型的捐赠者的眼睛中的表达。 Hageman说,“我们能够产生这些令人兴奋的结果,要感谢我们的眼睛捐赠者和他们的家人。我们非常感谢他们的珍贵礼物。”
Williams团队进行了许多困难和耗时的实验,以得出他们的突破性结论,这些结论与以前发表的文献报道的人类眼部组织或血液中的HtrA1无差异或水平升高相矛盾。Hageman指出,“那些特定的研究采用的样本太少,而且分析是利用神经视网膜和白细胞进行的,而不是视网膜色素上皮-布鲁赫膜,后者是AMD发病的主要部位。不幸的是,先前研究产生的数据导致了治疗方法的开发和测试--其中的一些目前正在进行人体临床试验---旨在减少HtrA1的总体水平,这一方法可能会加剧AMD的进展。我们的团队一直在孜孜不倦地追求准确性,进行了许多极其困难的实验来产生这些数据。他们年复一年地坚持不懈,我对这些数据和这个天才团队的科学敏锐度感到无比兴奋。”
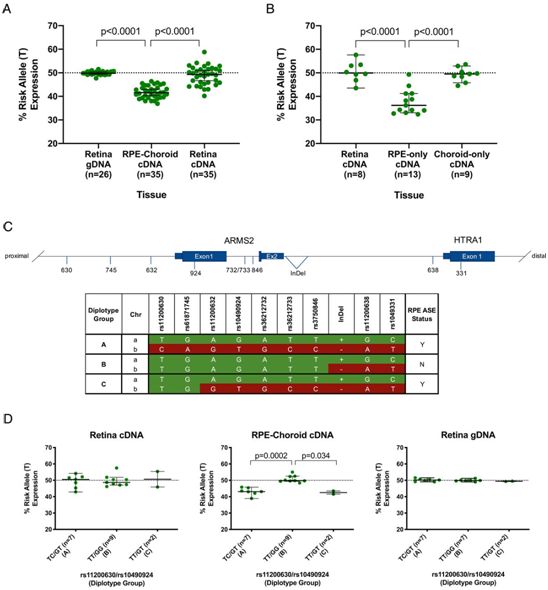
HTRA1等位基因特异的mRNA在人类供体组织中的表达,图片来自PNAS, 2021, doi:10.1073/pnas.2103617118。
Williams说,这项研究将产生广泛的影响。她说,“这些数据对整个领域和患有这种破坏性疾病的患者来说应该是很重要的,特别是考虑到正在开发的通过切除缺陷的DNA区域并修复它来校正基因的治疗技术。”
犹他大学转化医学中心的科学家和临床医生如今正专注于开发一种针对10号染色体相关的AMD的疗法。他们还为因异常基因位于1号染色体上而面临AMD风险的个体开发了一种潜在疗法。1号染色体和10号染色体加起来占了患AMD的遗传风险的50%以上。
这是Hageman在PNAS上发表的第二篇与AMD的主要遗传基础有关的文章。2005年,一篇具有里程碑意义的论文揭示了1号染色体上的补体因子H和相关基因的遗传变异和单倍型使个人容易患AMD。
莫兰眼科中心首席执行官Randall J Olson博士说,“当Hageman博士在近30年前开始他的AMD相关研究时,他是一名海洋生物学家,在这种可怕的致盲疾病被认为是无法治愈的疾病的时候,他决定转变方向,研究AMD。他不接受这种说法。我也不接受。因此,我们创建了犹他大学转化医学中心,作为一个独特的学术模式,旨在通过与慈善家和工业界以及国内和国际科学合作者的合作,迅速将发现转化为治疗手段。”
2014年,作为与艾尔建(Allergan)公司研发合作的一部分,一项重要的基因表达研究采用了700多名捐赠者和患者的各种眼部组织和血细胞,产生了约92亿个数据点,并揭示了与基因相关的AMD生物学有关的新见解。
Olson说,“很明显,我们的方法是有效的。Hageman博士和他的团队已经取得了很大的进展并将继续推进我们对AMD的了解,并开发治疗方法。”(生物谷 Bioon.com)
参考资料:
Brandi L. Williams el al. Chromosome 10q26–driven age-related macular degeneration is associated with reduced levels of HTRA1 in human retinal pigment epithelium. PNAS, 2021, doi:10.1073/pnas.2103617118.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


