Cell Stem Cell: TGF-β信号阻断是NK细胞有效对抗恶性肿瘤的必要条件
来源:网络 2024-07-30 10:17
本研究结果强烈表明,抑制TGF-β信号传导可显著提高NK细胞的抗肿瘤活性和体内持久性。
肝细胞癌(HCC)是最常见的原发性肝癌类型,也是一种高致死率的恶性肿瘤,5年生存率低于20%。因此,改进治疗方案是非常必要的。虽然靶向药物治疗如索拉非尼和其他激酶抑制剂用于治疗HCC,但这些治疗通常不能治愈。
免疫疗法(如阿特唑单抗)联合血管内皮生长因子(VEGF)抑制(贝伐单抗)目前是HCC的一线治疗方法,但疗效仍然有限。新的治疗方案旨在达到最小的残留疾病阴性完全缓解,有望减少复发的发生率和延长生存期。基于细胞的免疫疗法已被提出作为解决这一未满足的临床需求的一种选择。然而,使用T细胞和自然杀伤(NK)细胞治疗实体瘤仍然具有挑战性。
这些挑战包括肿瘤异质性、免疫细胞向肿瘤的充分运输以及免疫抑制肿瘤微环境(TME)。在TME中,免疫效应细胞可被多种细胞结合因子和可溶性因子抑制,从而损害其存活、激活、增殖和效应功能。事实上,虽然之前的研究已经测试了表达嵌合抗原受体(CAR)的T细胞或表达CAR的NK细胞对抗HCC,但临床疗效有限,至少有一项CAR-T细胞研究显示出明显的毒性。
NK细胞是先天免疫效应细胞,具有杀死病毒感染细胞和肿瘤细胞的固有能力,无需事先抗原致敏。NK细胞介导的细胞毒性受一系列激活和抑制受体的表达调节。活化的NK细胞可以通过颗粒依赖性途径释放颗粒酶和穿孔素杀死靶细胞,也可以通过死亡受体途径诱导细胞死亡。
一些临床试验已经证明,来源于外周血(PB-NK)、诱导多能干细胞(iPSCs)和脐带血(UCB-NK)的同种异体原代NK细胞,无论是否表达CAR,都是相对安全的,不会引起任何显著的毒性,如细胞因子释放综合征(CRS)、神经毒性和移植物抗宿主病(GVHD)。

图片来源:https://doi.org/10.1016/j.stem.2024.06.009
肝细胞癌(HCC)是最常见的原发性肝癌类型。转化生长因子β (TGF-β)在肝脏肿瘤微环境中高表达,已知可抑制免疫细胞活性。在本研究中,研究者使用人诱导多能干细胞(iPSCs)产生自然杀伤(NK)细胞,以介导抗hcc活性的提高。
具体来说,研究者生产了iPSC-NK细胞,这些细胞要么是敲除TGF-b受体2 (TGFBR2-KO),要么是表达TGF-β受体2 (TGFβR2-DN)的显性阴性(DN)形式,结合靶向GPC3或AFP的嵌合抗原受体(CARs)。TGFβR2-KO和TGFβR2-DN iPSC-NK细胞对TGF-β抑制具有抗性,抗hcc活性增强。
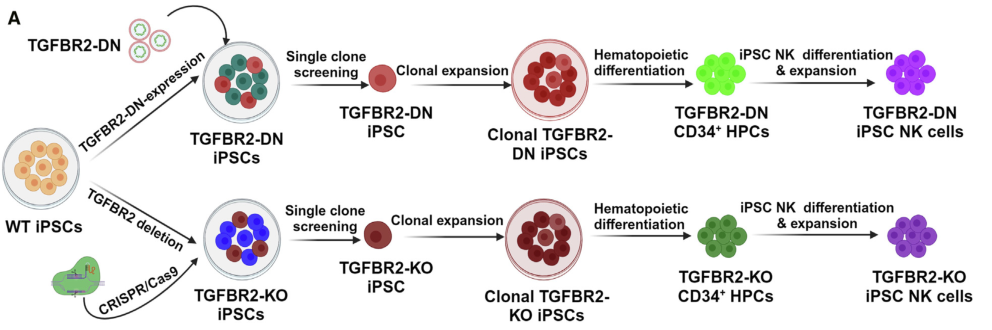
从人iPSCs衍生TGFBR2-KO和TGFBR2-DN iPSCs的综述
图片来源:https://doi.org/10.1016/j.stem.2024.06.009
然而,在iPSC-NK细胞上表达抗hcc CARs并不能产生有效的抗hcc活性,除非同时抑制TGF-β活性。本研究结果表明,TGF-β信号阻断是NK细胞有效对抗HCC和其他表达高水平TGF-β的潜在恶性肿瘤的必要条件。
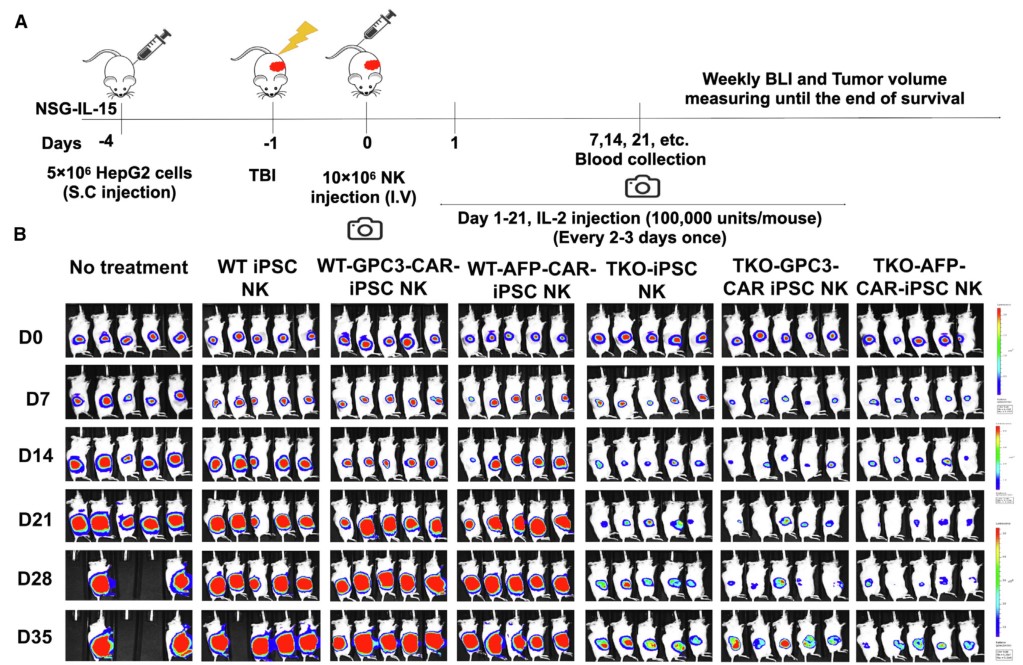
TGFBR2-KO ipsc衍生的NK细胞,无论是否具有抗hcc car,在体内对HepG2细胞表现出更好的抗肿瘤活性
图片来源:https://doi.org/10.1016/j.stem.2024.06.009
随着我们进入使用NK细胞靶向更具挑战性的恶性肿瘤的临床试验,这些研究表明,TGF-β信号的破坏为提高NK细胞(有或没有CAR表达)的抗肿瘤活性提供了一个关键途径,从而有效治疗HCC和其他潜在的难治性实体肿瘤。
本研究结果强烈表明,抑制TGF-β信号传导可显著提高NK细胞的抗肿瘤活性和体内持久性。尽管我们将CAR与TGFβR2-KO和WT-iPSC-NK细胞一起纳入研究,但本数据明确表明,杀伤活性的提高源于TGF-β信号的破坏,而不是来自CAR的表达。这突出了靶向TGF-β信号在实体瘤和其他恶性肿瘤中的重要性。
本研究为临床应用中通过靶向免疫抑制TME因子如TGF-β,无论是否表达CAR,用于治疗HCC和其他难治性实体肿瘤,提高NK细胞的抗肿瘤活性提供了令人信服的证据。(生物谷 Bioon.com)
参考文献:
Jaya Lakshmi Thangaraj et al. Disruption of TGF-b signaling pathway is required to mediate effective killing of hepatocellular carcinoma by human iPSC-derived NK cells. Cell Stem Cell. 2024 Jul 1:S1934-5909(24)00217-0. doi: 10.1016/j.stem.2024.06.009.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


