《细胞》子刊:首次发现睡眠巩固社交记忆的神经回路,陆军军医大学谌小维/覃涵团队最新研究成果
来源:奇点糕 2022-11-14 10:22
这项研究结合多种前沿技术,直接证明了在快速动眼睡眠睡眠时下丘脑和海马间存高度活动的神经群,而且两个神经回路在社交记忆和空间记忆的巩固中分别扮演重要角色。
作为社会性动物,我们可以在社交过程中识别并记住其他人,并且可以在随后的社交活动中使用这些社交记忆进行交流和抉择等行为[1]。
不难看出,社交记忆是正常社交的必要条件,对于人类的生存与繁衍非常重要。
睡眠和记忆的关系一直都备受瞩目,多数读者大概也有睡眠不足记忆力会下降的体验。
然而,巩固新编码的社交记忆所需的神经元回路目前仍然是未知的。
近日,来自陆军军医大学的谌小维和覃涵团队,通过小鼠模型发现了快速动眼睡眠(REM)可以巩固社交记忆的神经机制[2]。
他们利用钙流活体成像,光遗传学和活体单细胞电生理学等技术,发现下丘脑乳上核(SuM)投射到海马CA2区的神经元,在快速动眼睡眠期间呈现高度激活的状态,并且在快速动眼睡眠期间特异性抑制这群神经元会损害社交记忆。他们还发现,在快速动眼睡眠期间,特异性抑制SuM投射到海马齿状回(DG)的神经元则对社交记忆无明显影响。
这项工作首次证明了,快速动眼睡眠期间,下丘脑SuM投射到海马CA2神经元回路是巩固社交记忆所必需的。这项重要的研究成果在线发表在著名期刊Neuron上。

图1:论文封面截图
社交记忆是动物能够识别和记住相同物种成员的基础[3]。成功的记忆形成过程包括对社会新事物的编码,对新事物的回忆及后续的巩固[4]。目前,社交记忆的编码、表达和巩固的神经回路机制虽有研究,但是还不甚明了。
基于现有研究,目前的认知是,海马CA2神经元在面临外部社会新物种成员时被激活,并且这是编码社交记忆所必需的[5]。此外,社交记忆的编码与下丘脑SuM→海马CA2的投射密切相关[6]。接着,CA2神经元将信号传输到海马腹侧的CA1,而CA1的神经元可能负责存储社交记忆[7]。
对于记忆巩固,目前已知的是海马CA3神经元在非快速动眼睡眠的锐波涟漪(SWRs)期间的重新激活,是空间记忆巩固所必需的[8]。
然而,社交记忆是如何以及通过哪些特定神经回路在海马中得到巩固的仍是未解之谜。因此,谌小维和覃涵团队展开了研究,试图揭开这一谜底。
那下面就跟着奇点糕来看看他们是如何展开研究的吧。
首先,作者们通过病毒特定通路标记法,证实了存在下丘脑SuM→海马CA2的神经通路(SuMCA2投射神经元)和SuM→海马DG的神经通路(SuMDG投射神经元)(图2)。
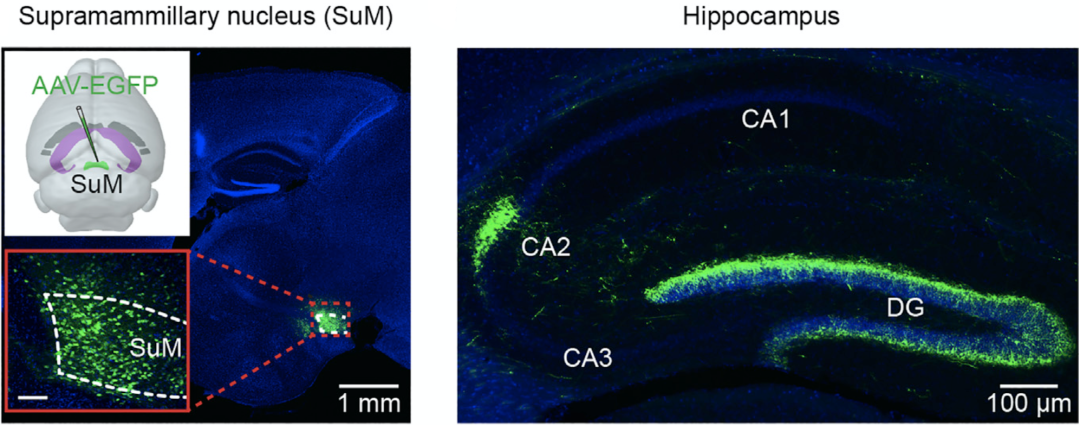
图2. 病毒特定通路标记表明证实了存在SuMCA2投射神经元和SuMDG投射神经元通路
接着,他们用逆行神经追踪的方法进一步证明了这两群神经元胞体都存在于SuM,并且他们发现SuMCA2投射神经元和SuMDG投射神经元是两个不同的神经细胞群。
由于先前的研究曾用染色的方法指明SuM的神经元在快速动眼睡眠和清醒情况下呈现激活状态,因此作者们接下来想探究SuMCA2投射神经元或者SuMDG投射神经元在快速动眼睡眠期间是否被高度激活。
为了探究这个问题,他们首先利用光纤记录法分别测量了CA2及DG处来自SuMCA2投射神经元或者SuMDG投射神经元的神经纤维的钙流反应。在此过程中,脑电图、肌电图的记录使得他们可以区分小鼠所处的不同状态,包括快速动眼睡眠,非快速动眼睡眠以及静息状态。
他们发现,两群神经元的神经纤维在快速动眼睡眠状态下的激活程度,明显高于非快速动眼睡眠和静息状态(图3、图4)。
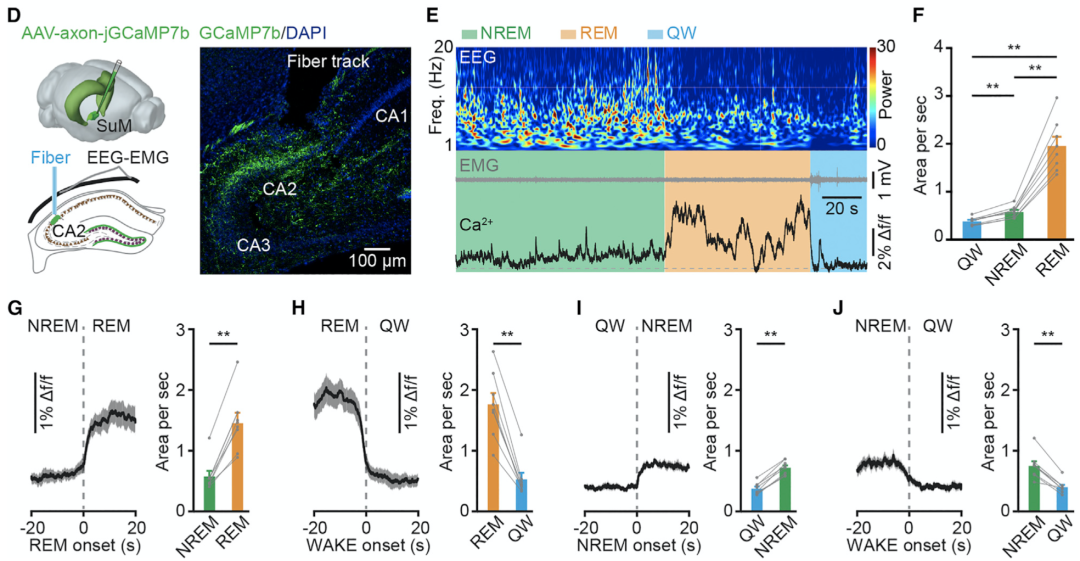
图3. SuMCA2投射神经元在快速动眼睡眠期间被高度激活

图4. SuMDG投射神经元在快速动眼睡眠期间被高度激活
接着,通过活体单细胞电生理学和光遗传学技术,他们证实了SuM的这两群神经元胞体(SuMCA2和SuMDG投射神经元)也特异性地在快速动眼睡眠期间呈现出高度激活的状态。
看到这些振奋人心的结果,大家肯定想问,SuMCA2或者SuMDG投射神经元在社交记忆的巩固过程中到底有没有贡献呢?
于是,作者们通过光遗传学和小鼠行为学研究,分别探究了这两群神经元在社交记忆巩固过程中的作用。他们发现,若SuMCA2投射神经元在快速动眼睡眠期间被特异性抑制,那么小鼠的社交记忆显著下降。
具体来说,相比于对照组,这些小鼠对于先前(睡眠前)所接触的新的社会成员仍表现为较大兴趣,表明它们并没有形成相应的社交记忆,也就是说它们不记得之前已经接触过此成员(图5)。
此外,他们还发现,这条神经回路在快速动眼睡眠期间被特异性抑制,对于空间记忆的巩固没有影响。
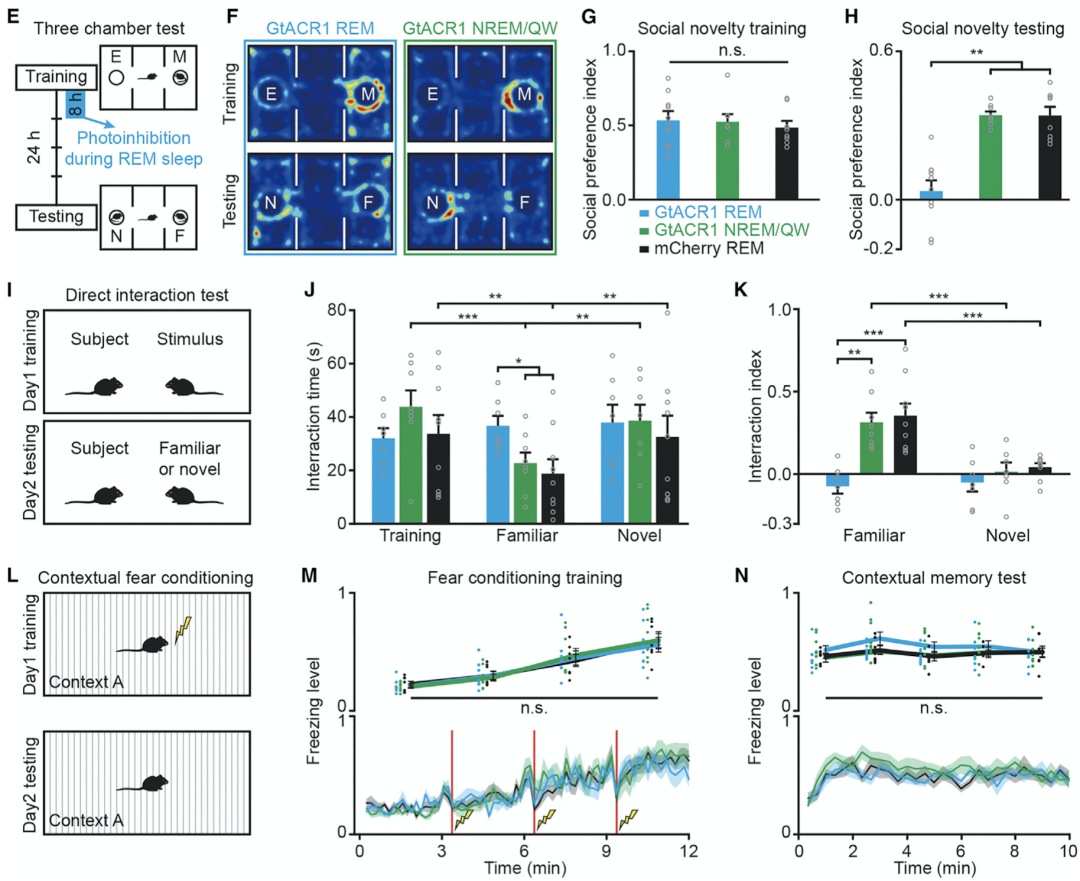
图5. 快速动眼睡眠期间特异性抑制SuMCA2投射神经元损害小鼠社交记忆不影响空间记忆
对于SuMDG投射神经元,作者们也进行了类似的研究。
他们发现,若SuMDG投射神经元在快速动眼睡眠期间被特异性抑制,小鼠的社交记忆不会受到显著影响,而空间记忆却明显下降。
总体而言,这项研究结合多种前沿技术,直接证明了在快速动眼睡眠睡眠时下丘脑和海马间存高度活动的神经群,而且两个神经回路在社交记忆和空间记忆的巩固中分别扮演重要角色。

图文摘要
此研究成果不仅加深了学界对社交记忆巩固神经回路的认识,也为将来临床上针对不同记忆障碍的干预提供了潜在靶点。
参考文献:
[1].柴安平. 孤独症易感基因调控社交记忆的神经可塑性机制[D]. 中国科学院大学,2016.
[2]. Qin H, Fu L, Jian T, et al. REM sleep-active hypothalamic neurons may contribute to hippocampal social-memory consolidation [published online ahead of print, 2022 Oct 18]. Neuron. 2022;S0896-6273(22)00809-1. doi:10.1016/j.neuron.2022.09.004
[3]. Lai WS, Ramiro LL, Yu HA, Johnston RE. Recognition of familiar individuals in golden hamsters: a new method and functional neuroanatomy. J Neurosci. 2005;25(49):11239-11247. doi:10.1523/JNEUROSCI.2124-05.2005
[4]. Straube B. An overview of the neuro-cognitive processes involved in the encoding, consolidation, and retrieval of true and false memories. Behav Brain Funct. 2012;8:35. Published 2012 Jul 24. doi:10.1186/1744-9081-8-35
[5]. Hitti FL, Siegelbaum SA. The hippocampal CA2 region is essential for social memory. Nature. 2014;508(7494):88-92. doi:10.1038/nature13028
[6]. Chen S, He L, Huang AJY, et al. A hypothalamic novelty signal modulates hippocampal memory. Nature. 2020;586(7828):270-274. doi:10.1038/s41586-020-2771-1
[7]. Meira T, Leroy F, Buss EW, Oliva A, Park J, Siegelbaum SA. A hippocampal circuit linking dorsal CA2 to ventral CA1 critical for social memory dynamics. Nat Commun. 2018;9(1):4163. Published 2018 Oct 9. doi:10.1038/s41467-018-06501-w
[8]. Rasch B, Born J. About sleep's role in memory. Physiol Rev. 2013;93(2):681-766. doi:10.1152/physrev.00032.2012
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


